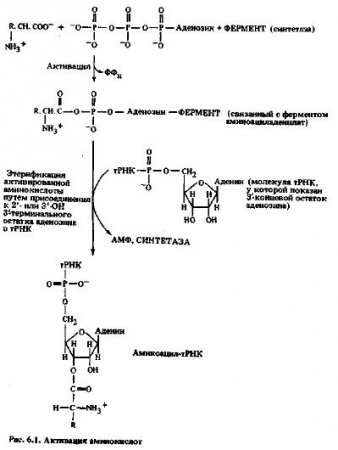
Активация аминокислот, синтез аминоацил-тРНК
Первым этапом биосинтеза белка является активация аминокислот в присутствии АТФ, ионов Mg2+ и ферментов, известных как аминоацил-тРНК-синтетазы (аминокислота: тРНК-лигазы), с образованием связанного с ферментом аминоациладенилата, или активированной аминокислоты. Тот же фермент, синтетаза, катализирует затем перенос аминокислоты с аминоациладенилата на специфичную молекулу тРНК. В молекуле аминоацил-тРНК аминокислота присоединена к тРНК сложноэфирной связью через 2‘- или 3'-оксигрупп концевого (3'-) остатка аденозина. Для каждой существующей в природе аминокислоты, по-видимому, есть только одна аминоацил-тРНК-синтетаза, хотя для данной аминокислоты в некоторых случаях известно несколько тРНК. В целом эту реакцию можно представить в виде двухэтапного процесса, изображенного на рисунке 6.1.
Для процесса биосинтеза белка характерна абсолютная специфичность включения нужных аминокислот в соответствующий участок полипептидной цепи. Аминоацил-тРНК-синтетаза должна различать потенциальные аминокислоты-субстраты и многочисленные виды тРНК в клетке, легко представать себе, какие сложности возникают при различении таких сходных по строению аминокислот, как аланин и глицин, изолейцин и валин. Было выдвинуто предположение о существовании процесса "редактирования", с помощью которого аминоацил-тРНК-синтетаза выбирает необходимые аминокислоты для активации и переноса на тРНК. Этот процесс происходит в активном центре фермента, где отбор по молекулярному размеру и химическим свойствам позволяет различать очень сходные аминокислоты.
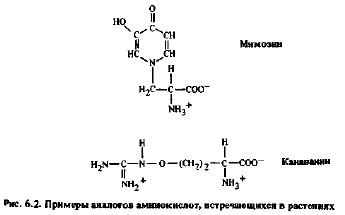
Нет данных о том, что при физиологических условиях аминоацил-тРНК-синтетазы могут ошибочно присоединять сосуществующие в природе аминокислоты не к той тРНК, и это свидетельствует в пользу существования подобного процесса редактирования. Действительно, некоторые растения содержат аналоги природных аминокислот, но аминоацил-тРНК-синтетазы этих растений различают такие аминокислоты при активации, в то время как соответствующие синтетазы растений, не содержащих аминокислот-аналогов, лишены такого дискриминирующего механизма и могут активировать аналог, а в некоторых случаях — даже присоединять сложноэфирной связью к тРНК. Примерами аналогов природных аминокислот, различаемых синтетазами растения-хозяина, являются азетидин-карбоновая кислота, аналог пролина, которая содержится в значительных количествах в тканях Polygomtum multiflorum (соломонова печать); канаванин, аналог аргинина, обнаруженный у Canavaita ensiformis, и мимозин, природный аналог фенилаланина, выделенный из тканей Mimosa и Leucaena (рис. 6.2).
Как только молекула тРНК нагружена нужной аминокислотой, она готова к выполнению своей роли молекулы-адаптора, расставляющего аминокислоты синтезируемого пептида по местам, т.e. в том порядке, который определяется мРНК в полисомном комплексе. Кроме того, после образования пептидной связи молекула тРНК удерживает растущую полипептидную цепь на рибосомах.