Элонгация пептидной цепи (часть 1)
Цепь белка синтезируется с N-конца путем последовательного прибавления аминокислот в процессе удлинения (элонгации) пептидной цепи. Этот повторяющийся процесс начинается с того, что растущая полипептидная цепь, соединенная сложноэфирной связью с тРНК, т.е. пептидил-тРНК, занимает донорный "П" участок рибосомы, акцепторный "А" участок пока свободен (рис. 6.4). Аминоацил-тРНК с антикодоном, комплементарным кодону мРНК, расположенному рядом с пептидил-тРНК, связывается затем с участком "А" [рис. 6.4, этап (1)]. Затем пептидил трансфераза, входящая в состав большой субъединицы рибосомы, катализирует образование пептидной связи между этерифицированной карбоксильной группой аминокислоты в пептидил-тРНК и α-аминогруппой аминокислоты в аминоацил-тРНК на участке "А", в результате чего к этому участку прикрепляется пептидил-тPHK, удлиненная на один аминокислотный остаток [рис. 6.4, этап (2)]. Теперь свободная тРНК, которая несла раньше пептид, отделяется от участка "П", а удлиненная пептидно-тРНК перемещается (транслоцируется) с "А" на освободившийся участок "П", в то время как молекула мРНК передвигается по отношению к рибосоме на один кодон [рис. 6.4, этап (4)]. Возникшее положение сходно с тем, которое существовало в начале цикла элонгации, с той только разницей, что на участке "А" открылся новый кодон мРНК, к которому может присоединиться новая аминоацил-тРНК. В процессе синтеза белка эти этапы элонгации многократно повторяются.
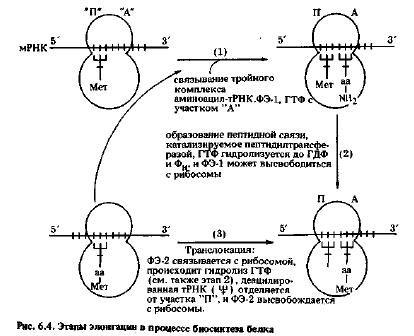
Конечным результатом одного цикла процесса элонгации является удлинение образующейся полипептидной цепи на один аминокислотный остаток. В клетках эукариот для этого процесса необходимо присутствие двух факторов элонгации, ФЭ-1 и ФЭ-2. Можно было бы ожидать спонтанного образования пептидной связи между пептидил-тРНК и аминоацил-тРНК, поскольку обе молекулы обладают высокой реакционной способностью, однако образование пептидной связи катализируется ферментом пептидилтрансферазой, белком, входящим в состав большой рибосомальной субъединицы. Избыток энергии, выделяемый при образовании пептидной связи и при гидролизе ГТФ в процессе элонгации, по-видимому, не нужен для образования самой связи, возможно, что эта энергия используется в цикле элонгации на стадии транслокации, поскольку процесс перемещения рибосомы и мРНК относительно друг друга требует затраты энергии.
Связывание аминоацил-тРНК с рибосомой. Посредником в связывании неинициаторной аминоацил-тРНК с участком "А" на 80S рибосоме служит фактор элонгации 1 (ФЭ-1), обнаруженный в самых различных клетках эукариот. В клетках млекопитающих активная мономерная форма ФЭ-1, обозначаемая как ФЭ-1Л, ют ФЭ-1α, состоит из одиночной полипептидной цепи, образующей агрегаты с другими молекулами ФЭ-1 или другими полипептидными комплексами, которые, возможно, служат посредниками в цикле ФЭ-1 в процессе связывания аминоацил-тРНК с рибосомой. Существуют данные о том, что ФЭ-1 а связан с комплементарным фактором ФЭ-10, который, по-видимому, способствует высвобождению ФЭ-1а.ГДФ из рибосомы после связывания аминоацил-тРНК и облегчает обмен ГТФ - ГДФ в этом бинарном комплексе.