Фотохимические эффекты
В процессе усвоения Fe-хелатов побегом важная роль принадлежит фотохимическим окислительно-восстановительным реакциям в системе Fе(III)-лиганд, сопровождающимся образованием двухвалентного железа. Функционирование этого механизма обусловлено необходимостью восстанавливать окисленные формы железа, которые образуются при передвижении из прото- в метаксилему поглощенных корнями форм Fe(II). Для осуществления метаболических процессов в растениях нужна двухвалентная форма железа. Ключевое значение Fe(II) определяется, с одной стороны, лучшем по сравнению с Fe(III) растворимостью его минеральных солей, а с другой — меньшей устойчивостью Fe(II)-хелатов, что облегчает высвобождение железа из транспортных форм и его дальнейшее включение в обмен веществ.
Фогоредукция Fe(III) дo Fe(II) происходит под действием оптического излучения с длинами волн меньше 420 нм. Оптическое излучение с распределением длин волн в диапазоне 350-700 нм способно проникать через интактный зеленый лист и вызывать фоторедукцию Fe(III) в питательном растворе. Этот процесс происходит как при прямом облучении растворов, так и при их освещении через пораженные хлорозом листья. При исключении из состава оптического облучения ультрафиолетовой (УФ) части фоторедукция Fe(III) подавляется. Стимулирующее влияние УФ-излучения на восстановление Fe(III) и синтез хлорофилла в листьях обнаружено в опытах с интактными растениями сои. При этом вызванные УФ-лучами физиологические эффекты усиливались по мере обострения Fe-дефицита и в наибольшей степени проявлялись у Fe-неэффектнвного сорта.
Фоторедукция Fe(III) происходит интенсивнее при участии органических соединений. в частности кислот. У растений под воздействием яркого солнечного света в аэробных условиях цитратный Fe(1II)-комплекс (одна из основных транспортных форм железа в растениях) легко разлагается с образованием двухвалентного железа. Механизм фотолиза карбоксилсодержащих хелатов железа и других микроэлементов (Mn, Co), заключается в элиминировании молекулы CO2 и последовательном сокращении хелатного цикла. В процессе фотолиза образуются промежуточные продукты со связями металл—углерод. Эти продукты термически нестабильны и распадаются с гемолитическим разрывом связи M-C и образованием ионов металла, а также радикалов лиганда. Фоторазложение, например, лимонной кислоты идет постепенно, с образованием многочисленных промежуточных соединений, конечные продукты — ацетон и углекислый газ. При фотораспаде ЭДТА идентифицированы следующие продукты: CO2, формальдегид, ионы этилендиаминтриацетата, этилендиаминдиацетата, Фотохимические окислительно-восстановительные реакции обнаружены не только в нитратных, но и а тартратных системах.
Фотохимическая активность Fе-хелатов и их физиологическое действие при некорневом питании зависят от многих факторов: природы комплексона, интенсивности и спектрального состава оптического излучения, реакции среды, содержания в составе Fe-xeлaтa других микроэлементов.
Природа комплексона. Один из основных факторов, влияющих на фотолиз хелатов. По стимулирующему действию на фоторедукцию Fe(III) в растворе природные органические кислоты располагаются в ряду: винная > щавелевая > лимонная > яблочная > аконитовая > фумаровая. Фотохимическая активность синтетических Fе-хелатов также варьирует в зависимости от природы лиганда (табл. 8.12). При этом максимальными квантовыми выходами фотохимических реакций характеризуются карбоновые, а минимальными — фосфоновые Fe-хелаты.

В ряду карбоновых комплексов также выявлены различия поэтому показателю. Квантовые выходы фотохимических реакций у среднеустойчивых хелатов: Fe-ЭДДА, Fe-HTA, выше, чем у высокоустойчивых: Fe-ДТПА, Fe-ЭДТА, Однако антихлорозное действие последних эффективнее, чем среднеустойчивых Fe-хелатов и тем более фосфоновых комплексов, которые не влияют на синтез хлорофилла в Fe-дефицитных листьях (рис. 8.9). Очевидно, при нанесении на поверхность листа фосфоновых Fe-xeлaтoв их фотохимическая инертность препятствует образованию биологически активных форм Fe(II). Различия в характере физиологического действия между фотохимически активными группами средне- и высокоустойчивых Fe-xeлатов могут быть обусловлены неодинаковым периодом их фотораспада. Комплексы с повышенной фотохимической активностью быстро разрушаются с увеличением продолжительности экспозиции (рис. 8.10), что сопровождается ингибированием фотовосстановления Fe(III) до Fe(II).
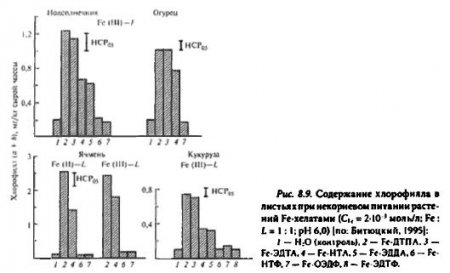
Следовательно, при некорневых подкормках быстрая фотодеструкция Fе-хелатов предопределяет ускоренную иммобилизацию железа в капле раствора вследствие плохой растворимости в воде его соединений. Этот процесс усугубляется относительно высокими значениями pH рабочих растворов и небольшим количеством хелатирующего агента, которое ограничено объемом капли на поверхности листа. Лучшим антихлорозным действием обладают комплексы железа, способные к интенсивной и пролонгированной фотохимической деструкции.
Оптическое излучение. Атрибутом любой фотохимической реакции выступает оптическое излучение определенного состава и интенсивности. Наибольший фотохимический эффект достигается при действии на хелатные комплексы микроэлементов излучением в области полосы максимального поглощения. Ярко выраженные симметричные полосы поглощения при длине волны 260 нм установлены в спектрах комплексов железа с ДТПА. ЭДТА, ЭДТФ. В спектрах среднеустойчивых комплексов (Fe-ЭДДА, Fe-HTA) при той же длине волны обнаруживается плечо. Валентность железа и реакция среды изменяют оптическую плотность, но не влияют на положение максимумов поглощения з спектре Fe-комплексонатов.
По мере исключения коротковолновой области из спектра источника облучения фотохимическая активность комплексонатов железа заметно снижается. В ряду карбоновых кислот фоторедукция Fe(III) в наибольшей степени подавляется s растворах с высокоустойчивыми синтетическими комплексами (Fe-ДТПА, Fe-ЭДТА), а в наименьшей степени — с природными органическими кислотами: цитратом, малатом, тартратом. Однако фотовосстановление окисного железа в растворах с карбоновыми лигандами,s отличие от растворов фосфорсодержащих комплексонов, отмечается даже при исключении УФ-области из спектра источника облучения. Ограничение светового потока в период проведения некорневых подкормок карбоновыми Fe-хелатами нарушает метаболизацию листьями железа из комплекса со средней фотохимической активностью (Fe-ДТПА), но не влияет на нее, если используются фотохимически высокоактивный комплекс (Fe-HTA) или минеральные соли.
Реакция среды. Вводных растворах фотохимически активных Fe-хелатов величины квантовых выходов фотохимических реакций выше в кислой среде, чем в нейтральной и щелочной. Антихлорозное действие этой группы хелатов также максимально в кислой среде. Как фотохимическая, так и физиологическая активность фосфорсодержащих комплексонатов железа сохраняется на низком уровне в широком диапазоне pH (4-9). Очевидно, пониженная скорость фотообразования Fe(II) лимитирует метаболизацию железа листьями растений при нейтральной и щелочной реакциях среды. Отметим, что эти результаты получены в экспериментах с гомогенными растворами Fe-комплексонатов. По этой причине отрицательное влияние повышенных значений pH на антихлорозную активность Fe-комплсксов при их нанесении на лист не может быть интерпретировано как деструкция хелатов.
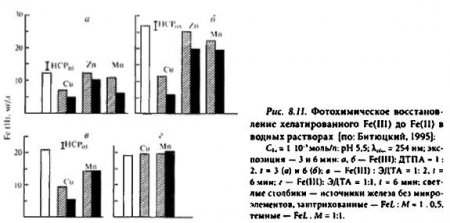
Влияние микроэлементов. Клеточный сок растений представляет собой многокомпонентную систему, в которой железо находится в окружении различных соединений других микроэлементов. Многие металлы-микроэлементы участвуют в регуляции фотохимической и физиологической активности Fe-хелатов. Воздействие на фотовосстановление Fe(III) микроэлементов определяется их природой и концентрацией, видом органического лиганда и величиной соотношения железо: микроэлемент: лиганд в растворе (рис. 8.11). При соотношении Fe:L = 1:2, достаточном для хелатирования всех металлов, обнаружено сильное (особенно на начальных этапах облучения) ингибирование фотохимического восстановления Fe(III) в присутствии меди и марганца. Например, при эквимолярном соотношении этих металлов с Fe(III) скорость его фотовосстановления уменьшается по сравнению с контролем на 50-80%. Влияние цинка на фотохимические реакции железа меньше, чем меди и марганца. При эквимолярном соотношении Fe : L, недостаточном для хелатирования привносимых микроэлеменов, не происходит подавления фотовосстановления Fe(III) ни марганцем, ни тем более цинком. В отличие от этого прибавление к эквимолярным комплексам железа меди может индуцировать, в силу ее высокой комплексообразующей способности, разрушение Fе-хелатов и образование нерастворимых в воде гидроксидов железа.
Фотохимические эффекты микроэлементов аналогичны физиологическим (рис. 8.12). Так, действие на хлорозные листья огурца хелатов железа с соотношением Fe :L = 1:2 сильно нарушается, если в растворах содержатся медь и марганец, а цинк на нега не влияет. В то же время излечивание хлороза не тормозится при использовании тех же количеств марганца из смеси с эквимолярным (Fe:L =1:1) комплексом железа (Fe-ЭДТА) и из FeSO4. Обработка листьев смесями этих соединений железа с медью подавляла его антихлорозное действие. В данном случае негативный физиологический эффект обусловлен потерей водорастворимости железа при взаимодействии с медью, о чем свидетельствует появление осадка.
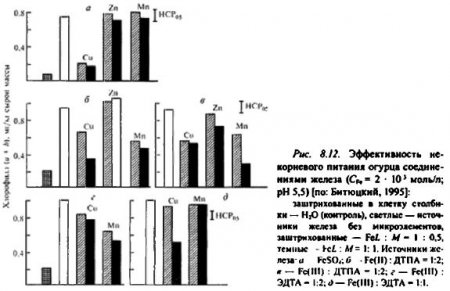
Ингибирование металлами фотохимического восстановления Fe(III) обусловлено известным в фотохимии эффектом тушения электронно-возбужденных состояний молекул. Существует точка зрения, что если тяжелый атом посторонний (не центральный), то достоверного тушения не происходит вследствие более эффективного влияния центрального иона комплекса на спин-орбитальное взаимодействие. Видимо, по этой причине марганец в композиции с эквимолярным комплексом Fe(III) не оказывает существенного воздействия на его фотовосстановление и физиологическую активность.
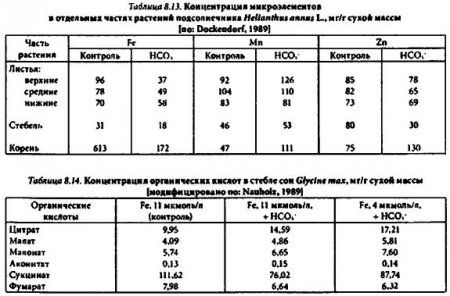
Результаты исследований с композициями микроэлементов позволяют объяснить один из возможных механизмов нарушения обмена железа у растений в условиях его недостатка. Вероятна следующая последовательность событий. Недостаток железа в питательной среде индуцирует сильное накопление в корнях и отдельных органах побега многих видов растений органических кислот и металлов-микроэлементов, особенно марганца (табл. 8.13; 8.14). Избыток хелатирующих соединений способствует ингибированию (тушению) микроэлементами фотохимических реакций в системе железо — хелатирующий агент, что усугубляет дефицит функционально активных форм Fe(H) и в целом негативно сказывается на фитометаболизме.
Фотовосстановление железа при некорневых подкормках, очевидно, происходит как на поверхности тканей в капле питательного раствора, так и непосредственно а тканях листа. После прохождения оптического излучения через эпидерму его интенсивность, а следовательно, и степень его участия в фотохимических реакциях многократно усиливаются вследствие фокусирующего действия эпидермальных клеток. Этот эффект, установленный с помощью микроволоконных оптических систем, обнаружен у растений различных видов.
В естественных условиях фоторазложение органических кислот, сопровождающееся восстановлением Fe(III) до Fe(II), локализовано в листе и рассматривается как один из механизмов адаптации растений к Fe crpeccy.
Физиологическое значение фоторедукции Fe(III) возрастает с обострением Fe-дефицита и становится особенно важным у Fe-неэффективных видов. Вместе с тем образование двухвалентной формы хелатированного железа нельзя рассматривать как достаточное условие для его включения в метаболизм побега. Этот процесс, вероятно, происходит только после фотодеструкции Fe-хелата.
Повышенные концентрации в тканях микроэлементов и высокие значения реакции среды негативно отражаются как на фотохимическом восстановлении железа в листе, так и на функционировании Fe-редуктаз корня и рассматриваются в качестве физиологических факторов обострения карбонатного хлороза растений.
На эффективность некорневых подкормок растений соединениями железа влияют многие факторы (рис. 8.13). Фотохимические реакции играют определяющую роль в усвоении листьями хелатов железа. Поэтому при некорневом питании к главным свойствам биологически активных форм соединений железа кроме их растворимости в воде относят фотохимическую активность.