Значение цинка в жизнедеятельности растений (часть 4)
Для выяснения связи цинка с белками в вакуолярном и плазматическом соках, полученных из листьев бобов, проводили осаждение белков 10%-ной трихлоруксусной кислотой. Затем белки последовательно промывали водой, раствором 1-н. уксуснокислого аммония и 0,02 м раствором трилона Б. Фильтраты выпаривали, сжигали и в них определялся цинк (табл. 141). Оказалось, что в молодых и средних листьях количество цинка, извлекаемого водой, в вакуолярном и плазматическом соках почти одинаково (36,79 против 35,74% и 15,52 против 14,89% общего его содержания в листьях), а в старых листьях в вакуолярном соке оно оказалось одинаковым с листьями молодого и среднего возраста (35,58%), но резко снижалось (почти в пять раз) в плазматическом. Обменная форма цинка в белках вакуолярного и плазматического соков молодых листьев не обнаружена, но отмечена в белках из сока старых листьев; средневозрастные листья занимали промежуточное положение. Хелатные формы связи цинка с белками обнаружены только в вакуолярном соке средних и старых по возрасту листьев.
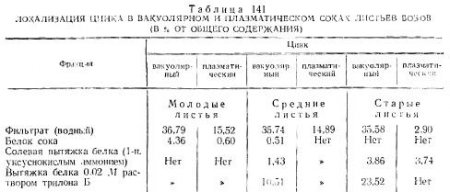
Наиболее прочно цинк связан с белками вакуолярного и плазматического соков молодых листьев и менее прочно — с белками вакуолярного сока средних листьев. Эти связи в молодом возрасте настолько прочны, что цинк не извлекается из белков даже раствором трилона Б, имеющего с ним высокую степень сродства. В листьях среднего возраста цинк частично извлекается из белков вакуолярного сока 1-н. раствором уксуснокислого аммония и почти полностью — раствором трилона Б. По мере старения листьев связь цинка с белками ослабевает, что подтверждается полным отсутствием его в белках плазматического сока листьев среднего возраста и белках вакуолярного и плазматического соков старых листьев после обработки их растворами уксуснокислого аммония и трилона Б.
По мере старения листьев содержание цинка в вакуолярном соке возрастало с 41,15 до 62,96% общего его содержания, а в плазматическом соке падало с 16,12 до 6,64%. Возможно, что накопление цинка в вакуолярном соке с возрастом происходит за счет десорбции его из плазматического сока и клеточных структур.
По данным А.В. Косицына с сотрудниками (1964, 1965), в клеточном соке листовой ткани томатов содержится около 80% цинка, который, по мнению авторов, находится в ионной форме или же в виде комплексов с низкомолекулярными органическими соединениями; он будто образует буферную систему для поддержания необходимой концентрации в физиологически активных центрах клетки, а низкомолекулярные его соединения в цитоплазме непосредственно участвуют в биохимических процессах. Я.В. Пейве (1960) также считает, что микроэлементы в клеточном соке растительных и животных тканей образуют хелатные связи с рядом низкомолекулярных соединений, в том числе с органическими кислотами (яблочной, лимонной) и аминокислотами.
В органических комплексах активность микроэлементов возрастает в сотни, тысячи, а иногда и в миллионы раз по сравнению с его ионным состоянием. Известно, что цинк может образовывать более или менее стойкие комплексы с различными органическими соединениями: белками, нуклеиновыми кислотами, АТФ и АДФ, амино- и органическими кислотами, сахарами, витаминами, антибиотиками, физиологически активными веществами, хелатами и рядом других.
В работах К.Б. Яцимирского и В.П. Васильева (1959), Чебрека и Мартелла (Chaberek a. Martell, 1959) приводится большой перечень веществ, с которыми цинк способен образовывать комплексы, а также даны константы стабильности этих соединений. По данным Брауна (Brown, 1963), вещества, образующие комплексы с цинком, по константам стабильности располагаются в следующем порядке: белки — пептиды — аминокислоты — естественные пурины — рибофлавин. Альберт (Albert, 1950), основываясь на своих исследованиях и работах других ученых, дает прямо противоположный порядок расположения комплексов металлов с органическими веществами по константам их стабильности. Он считает, что снижение прочности (по сравнению с аминокислотами) связи металла с пептидами и особенно белками является показателем их большей биологической активности.
В биологических системах лиганды (или адденды), доступные для образования комплексов с ограниченным числом катионов, широко варьируют. Например, ионы меди и цинка при оптимальном для физиологических процессов pH способны координировать с атомами серы и азота, но не кислорода, тогда как магний, марганец и калий — с кислородными донорами. Для железа являются специфичными комплексы с кислородными донорами и связи с фенольными группами. Вильямс (Williams, 1953) считает, что связь металлов с лигандами возможна через различные группы: первая — связь через атом алифатического азота; вторая — с алифатическим азотом и кислородом карбоксильной группы; третья — связь металла с лигандом через атом кислорода одной из групп адденда (карбоксильной, карбонильной или гидроксильной); четвертая — связь металла с лигандом через атом ароматического азота в производных пиридина.
Цинк является более стабильным по сравнению с другими ионами металлов в комплексах с аддендами, которые стереохимически расположены так, что пять тетраэдральных связей окружают центральный ион. Канн и Стевенсон (Khanna, Stewenson, 1962) значительную роль в образовании комплексов цинк — органическое вещество почвы отводят карбоксильным группам. Герд с сотрудниками (Gurd а. о., 1952) на основе сравнения констант стабильности меди и цинка с имидазолом и комплекса с альбумином пришел к выводу, что имидазольные боковые цепи в альбумине участвуют в связывании цинка в интервале pH 6,0—7,5.
Кроме того, в белках сильные связи с металлами образуют серусодержащие остатки, такие как цистеин и в меньшей степени гистидин. Сульф-гидрильная группа цистеина дает с цинком комплекс с высокой константой стойкости, тогда как простые одиночные группы — комплексы с меньшей константой. Тиоэфирная группа метионина образует слабые комплексы с цинком и другими бивалентными ионами. Клотц (Klotz, 1954), рассматривая типичные свойства полярных боковых цепей белков, делает заключение, что в сложные соединения с металлами, в том числе и цинком, вступают имидазольная, карбоксильная, фенольная, альфа- и гамма-аммонийные и сульфгидрильная группы. Аминокислоты образуют комплексы с металлами через карбоксильные или аминогруппы. Доказано существование связи цинка с серой у ряда ферментов.
Проведенными в Институте физиологии растений АН УССР исследованиями установлено, что основная масса цинковых комплексов, выделенных из листьев овса, имеет константы стабильности в пределах 9,3—16,4. Нерастворимые комплексы с константами стабильности ниже 9,3 отсутствуют (Островская, 1961).
Наши исследования показали, что в листьях бобов и сои значительная часть цинка находится в комплексе с амино- и органическими кислотами. Способность цинка образовывать комплексы с органическими веществами зависит от уровня насыщенности клетки цинком. Так, при минимальном содержании цинка в клетках листьев бобов и сои (использование очищенной от цинка питательной смеси Гельригеля) его в первую очередь обнаруживали во фракции аминокислот. По мере увеличения концентрации цинка в питательной среде и накопления его в растении количество этого микроэлемента во фракциях органических кислот и сахаров значительно возрастало. С помощью метода инфракрасной спектроскопии нами совместно с А.К. Мицюрой, Э.В. Рудаковой, В.И. Ивченко и Е.П. Козловской в 1967 г. показано, что цинк частично образует комплексы с фосфатной группой, пуриновыми и пиримидиновыми основаниями ДНК. С помощью метода колоночной хроматографии и различных веществ, образующих с цинком комплексы, мы установили, что в листьях сои основная масса комплексов цинка с аминокислотами имеет константы стабильности в пределах 1—2 и 7—10, что характерно для гетероциклических аминокислот типа триптофана, тирозина, пролина и др. По данным Альберта (Albert, 1950), наибольшим сродством с металлами характеризуются цистеин, пролин, триптофан. Наименее стабильные комплексы с цинком образуют аспарагин, серин, фенилаланин, аргинин, лизин и другие.
Органические кислоты листьев сои совместно с цинком образовывали соединения с константами стабильности в пределах 2—4 (это в основном органические кислоты алифатического ряда) и 7—9 (лигандами этих комплексов являются в основном циклические органические кислоты).
Кроме комплексов с аминокислотами, органическими кислотами и сахарами некоторая часть цинка в листьях бобов находится в связи с белками. Подтверждением этого являются полученные нами данные по содержанию цинка в различных фракциях белков, выделенных из листьев сахарной свеклы и семян различных сельскохозяйственных культур (Власюк, Лейденская, Рудакова, 1962; Рудакова, 1964). Оказалось, что цинк в листьях сахарной свеклы связан в основном с альбуминами (водная фракция) и в меньшей степени — с глутелинами (щелочная фракция). С возрастом в листьях прочность связи цинка с белками снижалась; уменьшалось также основное количество цинка в белках семян (микроэлемент находился в семенах в легкоподвижном состоянии и только незначительная часть его была связана с белками). Цинк связан со всеми группами белков, но в основном его обнаруживали в группе альбуминов и глобулинов. В семенах озимой пшеницы, кукурузы, сахарной свеклы и подсолнечника цинк наиболее прочно связан с белками группы проламинов (спирторастворимые белки).
Аналогичные выводы сделаны Бергом (Berg, 1952), который установил, что большая часть цинка в горошине, стручках и листовых пластинках находится в извлекаемом водой состоянии. Нерастворимый цинк оказался связанным с протеиновой фракцией. Способность цинка образовывать комплексы с белками имеет важное значение при рассмотрении и изучении его роли в ферментативных процессах.
В настоящее время установлено, что соединения металл — фермент, или металлосодержащие ферменты, относятся к карбоксилазе, декарбоксилазе щавелевоуксусной кислоты, альдолазе, щелочной фосфатазе и пирофосфатазе, энолазе, ди- и полипептидазе, дегидрогеназе фосфоглицеринового альдегида, триозофосфатдегидрогеназе и ряду других дегидрогеназ. Цинк с этими ферментами образует неспецифичные, диссоциирующие комплексы, из которых он может быть легко удален и заменен каким-либо другим металлом. Кроме того, металлосодержащие ферменты характеризуются настолько прочным включением единственного специфического металла в белковую основу, что оба компонента, по-видимому, составляют в природе одно целое и гомогенные металлсодержащие ферменты можно выделить и идентифицировать. Найдены пять цинксодержащих ферментов: карбоангидраза, карбоксипептидаза, алкогольдегидрогеназа, глутаматдегидрогеназа и лактатдегидрогеназа. Однако при удалении цинка из карбоангидразы ортофенантролином, образующим с ним внутрикомплексные соединения, медь, кобальт, особенно марганец, заменяли цинк в этом ферменте (Eckert, 1961).
Пo данным Вильямса (Williams, 1953), хотя ион меди и может замещать цинк в карбоангидразе, активность фермента значительно падает. Валли, Раплей, Кумбс и Нейрат (Vallee, Rupley, Coombs, Neurath, 1960) показали, что в карбоксипептидазе при удалении цинка многие металлы (хром, марганец, железо и др.) реактивировали его.
Следует отметить, что в цинксодержащих ферментах металл входит в активную группу, содержащую кроме него и пиридиннуклеотиды, которые непрочно связаны и легко отделяются от белковой части. По данным Фридена (Friden, 1959) и Кэги (Kagi, 1959), цинк служит поперечносвязывающим промежуточным звеном в поддержании макромолекулярной структуры белков таких ферментов, как амилаза, алкогольдегидрогеназа и глутамин дегидрогеназа.
Фермент карбоангидраза оказывает каталитическое действие на течение обратимой реакции расщепления угольной кислоты на углекислый газ и воду с образованием нестабильного комплекса цинка с углекислым газом (молекулярный вес 30 000, содержание цинка 0,2—0,3%). Впервые идентифицировали цинк в качестве компонента карбоангидразы, используя фермент, выделенный из эритроцитов быка. Этот фермент получен в кристаллическом виде и представляет собой протеид, в котором на одну молекулу белка приходится два атома цинка. В карбоангидразе цинк прочно связан с белковыми компонентами и не удаляется при электродиализе.
Карбоангидраза широко распространена в организмах позвоночных и беспозвоночные животных. Открытие ее в листьях многих высших растении (как в хлоропластах, так и других частях клетки) свидетельствует об универсальности распространения этого фермента. В литературе встречаются указания об отсутствии карбоангидразы в корнях растений, листьях картофеля, сахарной свеклы, салата, а также в некоторых одноклеточных водорослях. Однако И.И. Гунар и Е.Е. Крастина (1952) в корнях кукурузы и гороха обнаружили карбоангидразу, которая по своей реакции на ингибиторы ничем не отличалась от фермента листьев.
Карбоангидраза растений также содержит цинк, но в наиболее очищенных препаратах фермента, полученных Сибли и Вудом (Sibly, Wood, 1951), согласно данным полярографических измерений, было только 0,056% этого микроэлемента, который не удалялся при диализе против воды. Отличаясь низким содержанием цинка, карбоангидраза растений более устойчива к угнетению цианистым калием, хотя азид при концентрации 10в-3 M вызывает ее инактивацию приблизительно на 75% (Хох, Валли, 1962). У растений, выращенных на среде с недостаточностью цинка, наблюдалась корреляция низкого его содержания с низкой карбоангидразной активностью и низким содержанием белкового азота. Исследования В.Е. Мицык (1965) показали, что подкормка жвачных животных цинком повышает активность карбоангидразы в два раза. Однако некоторые ученые указывают на то, что между содержанием цинка и активностью карбоангидразы не всегда наблюдалась прямая зависимость.
Полученные нами совместно с Э.В. Рудаковой данные (табл. 142) свидетельствуют о том, что активность карбоангидразы у одних растений (кукуруза) коррелирует с содержанием цинка в питательной среде, тогда как у других (соя) такой закономерности не наблюдается (табл. 143).