Значение железа в жизнедеятельности растений (часть 3)
Сопоставляя многочисленные экспериментальные данные при изучении особенностей синтеза флавинов и принимая во внимание ту физиологическую роль, которую играет рибофлавин в ферментных реакциях, можно представить и механизм действия ингибиторов железа. Рибофлавин является ко-ферментом большой группы окислительно-восстановительных ферментов, активирующихся железом. Перенос электронов флавиновыми ферментами осуществляется путем изменения валентности, так как железо входит в структурную единицу активного центра фермента. Применение КЦФ как ингибитора окислительного фосфорилирования и азида как ингибитора дыхания позволяло во многих случаях дифференцировать чувствительные и резистентные, формы бобовых и цитрусовых растений. Поэтому Уоллес и Де-Кок допускают, что метаболический механизм, транспортирующий железо, является фактором, определяющим чувствительность растений к железному хлорозу.
У табака и других пасленовых растений установлены специфические особенности в транспортировании железа, что и определяет большую их устойчивость к хлорозу, чем бобовых и сложноцветных растений. Табак, например, может расти некоторое время на питательном растворе без железа, эффективно используя его запасы из ранее накопленных в корнях веществ, обладающих значительными хелатирующими свойствами. Однако добавление к питательному раствору бикарбоната кальция прекращает транспортировку железа из корней к точкам роста, что связано с нарушением нормальных соотношений между фосфором и железом, калием и кальцием. Поступление железа контролируется путем образования железо-белкового комплекса (трансферрина). При этом допускается, что у некоторых видов растений переносчиком железа являются цитраты, так как поступление кальция угнетает процесс образования яблочной кислоты в цикле лимонной и изменяет активность фермента аконитазы, активируемого железом.
Поэтому устойчивость растений к железному хлорозу в известной степени связана с выделением их корневыми системами хелатирующих агентов, которые образуют хелатные комплексы с железом, обладающие более высокими константами устойчивости, чем имеющиеся в почве. Например, хлороз злаковых растений наблюдается лишь в водных культурах при абсолютной недостаточности железа. На карбонатных почвах, вызывающих острый хлороз у многих видов растений, в частности у бобовых, пасленовых, розовых, злаки хорошо растут и плодоносят.
Химическая топография растительных тканей и органов по отношению к железу изучена недостаточно, значительно меньше, чем у животных. Это относится к семенам, цветкам, листьям, корням. Содержание железа в листьях гороха, по данным Г.А. Овчаренко (1965), составляет 44—47 мг/кг сухого вещества в начальные фазы вегетации; 132—183 — в период цветения и 327—594 мг/кг — к концу вегетации; проса — соответственно 84—159; 84—282 и 197—319 мг/кг. К концу вегетации у гороха в стеблях обнаружено железа 81 —147, в семенах — 29—97, в створках — 23—117 мг/кг; у проса в стеблях — 51—57 и в семенах — 4—26 мг/кг.
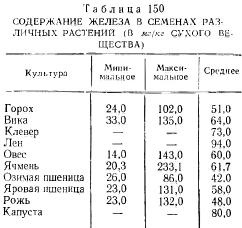
По данным К.К. Бамберга (1956), колебания в обогащенности семян железом очень значительны, особенно у злаковых (овес, ячмень) и бобовых (горох, вика) растений (табл. 150). В семенах кукурузы, по данным М.С. Гамаюновой (1965), железа было 30,8—36,9 мг; озимой пшеницы — 27,3—44,7; овса — 15,6—30,4 мг/кг сухого вещества.
Содержание железа в семенах зависит от количества его в почве и от наличия карбоната кальция, которое определяет доступность почвенного железа. Органографию железа в семенах П.А. Колесников и А.А. Мутаскин (1963) связывают со щитком, который у кукурузы, пшеницы и других растений наиболее обогащен железом. В щитке обнаружено 67—90% железа (от общего его количества в семени), что составляет 1,4—3,7 мг/кг сухого вещества; это соотношение отличается определенным постоянством. Эндосперм содержит 19,1% железа, оболочка — 9, зародыши — 6,2% и т.д. Однако на единицу веса в зародыше железа приходится в 20 раз больше, чем в эндосперме, что связано с повышенной избирательной способностью зародыша по отношению к железу, которая закрепилась отбором.
Щиток является запасающей тканью (по отношению к железу), которая обогащена железо-протеиновыми комплексами, или фитоферритинами. Эти комплексы — аналоги железоферритина, выполняющего соответствующую функцию в тканях животных. Фитоферритины щитка используются растением в процессе формирования хлоропластов в клетках в ходе развития синтетического аппарата.
Характер распределения железа в клеточных структурах листьев люпина, по данным С.Г. Петренко (1965), также отличается определенным постоянством и зависит от поступления металла из комплекса Fe-ДТПУ (диэтилентриаминпентауксусная кислота), от разновидности почвы и других условий минерального питания (табл. 151). На карбонатной почве все растения отличались высоким абсолютным и относительным содержанием железа в безбелковой надосадочной жидкости (41%), в хлоропластах, ядрах и митохондриях (33,5%).
Максимальное относительное содержание железа в хлоропластах (38%) было отмечено в варианте с Fe-ДТПУ. Fe-ДТПУ является наиболее устойчивым хелатным комплексом в условиях карбонатных почв. Синтез и технология его производства были разработаны Институтом особо чистых веществ и химических реактивов и оправдали себя при испытании на карбонатных почвах УССР.
Внесение комплексных соединений железа изменяет содержание его доступных форм в почве, а также доступность для растений и других микроэлементов, которые в силу разных причин могут вытеснять внесенные металлы из комплексов. Это свидетельствует о том, что для включения железа в общий обмен веществ и синтез хлорофилла значительную роль играет не только абсолютное содержание этого элемента в тканях, но и форма его и соотношение различных соединений железа и других микро- и макроэлементов в растении.
Последнее подтверждается опытами с внесением в почву в качестве источников железа соединений Fe59. Из комплекса Fе59-ДТПУ железо поглощается растением гораздо интенсивнее, чем из неорганических солей. В хлоропластах листьев у люпина, выращенного на Р59-ДТПУ, радиоактивного железа было в 16 раз больше чем у растений, получавших Fe59Cl3 (табл. 152). Накопление в хлоропластах избыточного количества железа, не участвовавшего непосредственно в синтезе хлорофилла, свидетельствует о том, что активное железо может находиться в запасной форме, которая концентрируется в депо хлоропластов.