Общая характеристика поглотительных систем
Поглощение микроэлементов растениями из почвы носит мультифазный характер. Количество фаз поглощения и величины кинетических констант значительно варьируют даже для одного иона в зависимости от особенностей генотипа, возраста растений, диапазона концентраций, продолжительности эксперимента, взаимодействия с другими ионами (рис. 3.1).
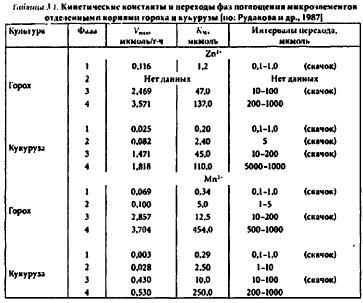
Выделяют следующие основные фазы (табл. 3.1) в кинетике поглощения микроэлементов растениями: 1) фала обменной адсорбции (продолжительность до 20 мин); 2) фаза насыщения свободною пространства (1-3 ч); 3) и 4) - фазы активного поглощения (до 6 ч и более).
В поглощении микроэлементов отмечают пассивный и активный компоненты, соотношение между ними может сильно изменяться в зависимости от свойств и концентрации элемента, биологических особенностей и возраста культур. Связывание катионов микроэлементов клеточными стенками происходит с помощью ионизированных карбоксильных групп полисахаридов (пектиновых веществ, целлюлоз, гемицеллюлоз) и гликопротеинов, входящих в состав матрикса. Эти группы обеспечивают большое число отрицательных фиксированных зарядов в клеточной стенке.
Поглощение катионов осуществляется пропорционально числу свободных карбоксильных групп, содержащихся в клеточных стенках. Микроэлементы могут связываться и карбоксильными группами белков. Однако эти группы сосредоточены главным образом в пектиновых веществах, во фракции которых концентрируются и микроэлементы.
Удаление пектиновых веществ из клетки сопровождается резким снижением поглощения микроэлементов. Растения, содержащие в корнях много пектиновых веществ, как правило, поглощают и большие количества микроэлементов. Например, корни гороха адсорбируют значительно больше цинка и марганца, чем корни кукурузы. Эти различия объясняют большей (примерно на порядок) обогащенностью корней гороха пектиновыми веществами. С помощью специальных методик, позволяющих последовательно удалять из клеточных стенок различные функциональные группы, установлено, что разрушение только карбоксильных групп приводит к элиминированию поглощения ионов клеточными оболочками. Кроме карбоксильных групп в поглощении ионов принимают участие и другие функциональные группы, заряженные как отрицательно (гидроксильные, фосфатные), так и положительно (аминные). Последние придают клеточной стенке анионообменные свойства.
Прочность связи микроэлементов клеточными стенками сильно варьирует в зависимости от физико-химической природы ионов и их концентрации в среде. По устойчивости образуемых с клеточной стенкой связей двухвалентные катионы металлов-микроэлементов располагаются в ряду: Cu2+ > Zn2+ > Fe2+ > Mn2+. С увеличением степени окисленности металлов их сродство к клеточным стенкам возрастает. Поглощение анионов микроэлементов (бор. молибден) из растворов с их низким содержанием сильно замедлено вследствие электростатического отталкивания одноименных зарядов анионов и клеточных стенок.
Прежде чем лопасть в симпласт растений локализованные в питательной среде микроэлементы должны пересечь клеточные мембраны, в частности плаэмалемму клеток корней. В результате последних исследований в области молекулярной биологии выявлены следующие поглотительные системы, участвующие в мембранном транспорте металлов.
АТФазы. Широко распространены АТФазы P-типа: Н+-АТФаэы у растений и грибов, Nа+/K+-АТФаэы у животных и Ca2+-АТФазы у различных организмов. Ферменты этого семейства осуществляют активный транспорт специфичных для них катионов через клеточные мембраны за счет энергии гидролиза АТФ. Обычно АТФазы P-типа состоят из 8-12 трансмембранных доменов и длинной цитоплазматической петли с участками для фосфорилирования.
АТФазы, транспортирующие тяжелые металлы, состоят, предположительно из шести-восьми трансмембранных доменов и относятся к подсемейству P18. Эта группа называется также CPх-АТФазы, так как белки этой группы содержат на участке внутри мембраны следующую последовательность аминокислот: цистеик-пролин-цистеин/гмстилин/серин. АТФазы этого подсемейства могут участвовать в переносе через мембраны либо одно-, либо двухвалентных катионов: Cu+. Cu2+, Zn2+, Co2+, Cd2+, Pb2+.
Белки семейства ABC. Белки этого семейства (ATP-binding Cassette) представляют собой кассеты, связывающие АТФ. Они широко распространены у всех организмов, выполняют транспортные функции. Включают два домена: гидрофобный трансмембранный домен, состоящий из четырех или шести трансмембранных пролетов, и периферический, локализованный в цитозоле домен, связывающий АТФ или нуклеозиды. Помпы такого типа работают за счет энергии, получаемой при гидролизе АТФ, и транспортируют через мембраны различные вещества: ионы, сахара, липиды, пептиды, пигменты, ксенобиотики, антибиотики. У растений такие белки задействованы в транспорте в вакуоль кадмия. В вакуоли корней овса этот металл поступал в форме хелата. АВС-белки могут быть задействованы в транспорте Mn2+, но пока это доказано только для цианобактерий
Synechocysiis. В корнях ячменя идентифицирован новый локализованный в тонопласте транспортер, синтез которого индуцировался дефицитом железа. Природа транспортируемых этим белком субстратов пока не установлена.
Белки семейства Nramp. Это семейство (Natural Resistance Associated Macrophage Proteins) представлено у всех организмов интегральными мембранными белками, участвующими в транспорте ионов. У растений белки этого семейства впервые идентифицированы у риса. Растительные белки Nramp (обнаружены в растениях
Arabidopsis thaliana) делят на два подсемейства: AtNramps 1 и 6. AtNramps 2-5. Растительные белки первой группы хорошо сохранились в ходе эволюции, состоят их 12 доменов в расчете на одну молекулу. Некоторые представители белков Nramps вовлечены в транспорт железа или марганца. Например, в корнях Arabidopsis синтез белков AtNramp 1, 3 и 4 регулируется уровнем снабжения растений железом. Кроме того, белок AtNramp 3 вовлечен в поглощение не только железа, но и кадмия. Этот белок синтезируется также в проводящих сосудах корней, стеблей и листьев, т. е. участвует в дальнем транспорте металлов.
У томатов гены
LeNrampl, локализованные в сосудистой паренхиме, специфически активируются недостатком железа и предположительно задействованы в синтезе транспортеров. участвующих в мобилизации железа в сосудах (Bereczky et al., 2003). Таким образом, выполняя различные функции, некоторые представители этого семейств* задействованы в транспорте железа.
Семейство белков, облегчающих диффузию (CDF). Белки семейства CDF (Cation Diffusion Facilitator) облегчают диффузию ионов через мембраны. Представители этого семейства, обнаруженные в клетках дрожжей, животных и растений, вовлечены в транспорт цинка, кобальта и кадмия. Эти белки состоят из шести доменов, имеют N- и С-терминальные участки, причем в связывании катионов задействованы последние. У представителей эукариот обнаружен обогащенный гистидином домен, способный связывать цинк.
В растениях
Arabidopsis идентифицированы гены ZAT, экспрессия которых усиливалась с возрастанием в среде концентрации цинка. Предполагают, что белки ZAT участвуют в перераспределении цинка между везикулами и вакуолями и, следовательно, вовлечены в поддержание в растениях Zn-гомеостаза.
Белки семейства ZIP. Белки ZIP (ZRT/IRT-related Proteins): ZRT (Zinc Regelated Transporter), IRT (Iron Regulatet Transporter), участвуют в транспорте таких металлов, как железо, цинк, марганец и кадмий. Около 85 белков ZIP найдено у бактерий, архей, а также у всех представителей эукариот. У этих бел ков обнаружено по восемь трансмембранных доменов на молекулу, имеющую расположенные по обе стороны мембраны амино- и карбоксильный концы. Участок молекулы, ответственный за связывание катионов, богат остатками гистидина.
Белки, участвующие в катион/Н+-антипорте. В тонопласте растений обнаружено несколько белков этого семейства, участвующих в регуляции концентрации ионов в цитоплазме путем их перемещения в вакуоль. Вовлеченные в Cd2+/H+-аитипорт белки, кодируемые генами САХ2, способствуют аккумуляции Cd2+ в вакуолях. У табака экспрессия этих генов сопровождалась усилением аккумуляции Ca2+, Cd2+ и Mn2+ в растениях, а также Cd2+ и Mn2+ в везикулах тонопласта в корне. Из белков семейства CAX только белок САХ2 способен участвовать в вакуолярном транспорте микроэлемента Mn2+.
Другие белки. У растений
Arabidopsis и других видов обнаружены регулируемые нуклеотидами каналы, аналогичные таковым у животных. В частности, выделены белки GNGC, предположительно содержащие шесть трансмембранных участков и один участок, связывающий кальмодулин. Эти неселективные к переносимым ионам каналы, локализованные в плазмалемме, проницаемы для одно- и двухвалентных катионов. У табака выделены белки NtCBP4, связанные с транспортом в растения Ni2+. У злаков обнаружен транспортер для фитосидерофоркых Fe3+-комплвксов. Возможно, транспорт молибдена через плазмалемму также осуществляется с помощью белков этой группы, задействованных, как известно, в поглощении сульфатов и фосфатов. Однако гены, кодирующие синтез переносящих молибден специфических белков, пока не обнаружены.
В поглощении одного микроэлемента могут участвовать несколько белков-транспортеров (рис 3.2). Железо может транспортироваться через мембраны белками Nramps и ZIP, а марганец, кроме того, Са2+-АТФазами и белками, участвующими в катион/Н- антипорте. Доказана возможность транспортировки цинка белками семейств CDF и ZIP. Некоторые белки семейства Nramps способны осуществлять перенос не только ионов металлов, но и других субстратов, причем такой транспорт осуществляется не только внутрь клетки, но и в обратном направлении. Задействованные в транспорте металлов белки характеризуются как высоким, так и низким сродством к переносимым ионам. Широкий спектр генов, участвующих в синтезе транспортных белков, предоставляет возможность для функционирования регуляторных механизмов, способствующих адаптации растений к разнообразным условиям обеспеченности среды микроэлементами.