Формы и функции железа в растениях
Химический элемент VIII группы периодической системы Менделеева. Атомный номер 26, атомная масса 55,847; блестящий серебристо-белый металл. Элемент в природе состоит из четырех стабильных изотопов: 54Fe (5,84%), 56Fe (91,68%), 57Fe (2,17%) и 58Fe <031%). Относительно невысокие значения энергии ионизации атома железа (Fe) обусловливают слабую связь внешних электронов с ядром, проявление элементом положительной валентности в соединениях и характерных свойств металлов. Особенности строения атома железа, типичные для переходных элементов, определяют переменную валентность этого металла (Fe2+/Fe1+) и ярко выраженную способность к комплексообразованию. Эти химические свойства и определяют основные функции железа в растениях.
В окислительно-восстановительных реакциях железо участвует как в гемовых, так и в негемовых формах. В Киотской энциклопедии генов и геномов приведен список различных ферментов, из них 40 содержат в своем составе гем, 99 — негемовые формы железа.
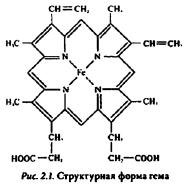
Гем — распространенный в биологических системах кофактор (рис. 2.1). Хорошо известными гемовыми белками являются цитохромы — важнейшие компоненты окислительно-восстановительных систем хлоропластов, митохондрий, некоторые ферменты (пероксидазы, ката лазы), леггемоглобин. Биосинтез гемовых форм связен с синтезом хлорофилла. Конечная стадия биосинтеза гема — включение Fe2+ в протопорфирин IX — осуществляется с помощью феррохелатазы. Этот мономер с молекулярной массой около 40 кД осуществляет реакцию без участия каких-либо дополнительных кофакторов. Аналогичные по составу хелатазы ответственны за включение магния в состав хлорофилла.
У арабидопсиса выявлено два ответственных за синтез фитохелатазы гена: AtFCl и AtFCIl. Если экспрессия первого гена (AtFCI) обнаружена во всех тканях растений, то экспрессия второго гена (AtFCIl) — только в аэрируемых тканях. Более 90% активности фитохелатазы приурочено к пластидам, т. е. пластиды — основное место синтеза гемовых соединений как в фотосинтетических, так и в нефотосинтетических тканях высших растений. В корнях основной пул гемовых соединений сосредоточен за пределами пластид; вероятно, существует механизм транспорта гемовых соединений из пластид в другие компартменты растительных клеток. Кроме пластид гемовые фирмы могут также синтезироваться в митохондриях.
Потенциальным донором железа для синтеза его гемовых форм внутри пластид служит ферритин. Этот запасной белок может содержаться и в митохондриях.
Электронтранспортная цепь (ЭТЦ) фотосинтеза, встроенная в мембрану тилакоида, состоит из трех пигмент-белковых комплексов: ФС 2, ФС 1 и цитохромного b/f-комплекса. В дыхательной ЭТЦ митохондрий направление переноса электронов определяется величиной окислительно-восстановительного потенциала цитохромов:
цит. b → цит. с1 → цит. с → цит. аа3 → О2.
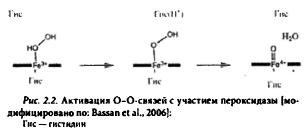
Пероксидазы. Гемовые формы пероксидаз обнаружены во всех наземных растениях. В каталитическом цикле пероксидазы участвуют в восстановлении пероксида водорода путем окисления различных эндогенных молекул-доноров: фенольных соединений, предшественников лигнина, ауксина или вторичных метаболитов. В реакциях активации О-О-связей с участием пероксидаз (рис. 2.2) образуется промежуточный продукт Fе4+=O. что было установлено методами спектроскопии.
Пероксидазы катализируют множество реакций и поэтом у участвуют в разнообразных физиологических процессах. Реакции с участием пероксидаз ведут к образованию множества активных форм кислорода, способных влиять на активность различных процессов или участвовать в передаче сигналов (рис. 2.3). Участие этих форм проявляется со стадии прорастания до завершающих этапов онтогенеза растений. Выделение пероксидаз и таких форм кислорода зафиксировано в опытах с Raphanus sativus. Пероксидазы способны генерировать пероксид водорода (H2O2) и соответственно радикалы ОН в реакциях гидроксилирования. Активные формы кислорода, выделяемые в этом цикле, могут играть положительную роль в защите семян от патогенных организмов. В опытах с томатами
(Lycopersicon esculentum) экспрессия генов пероксидазы совпадала с началом прорастания семян.
Эндогенный уровень пероксида водорода влияет на растяжение клеток. Например, у двудольных растений (соя) в зоне растяжения гипокотиля отмечен пониженный уровень апопластных форм пероксида водорода. Удлинение корня
A. thaliana во время его изгиба также зависело от концентрации пероксида водорода. Поскольку пероксидаза контролирует уровень последнего, она непосредственно вовлечена в процесс растяжения клеток. Кроме того, пероксидазы участвуют в реакциях полимеризации: катализируют перекрестное связывание компонентов клеточной стенки, а также участвуют в биосинтезе лигнина и суберина. На растяжение и увеличение объемов клеток может влиять аскорбиновая кислота путем ингибирования ферментов, способных снижать эластичность клеточной стенки. Например, активность апопластной пероксидазы, участвующей в контроле над растяжением, ингибировалась в присутствии аскорбата.
Фермент пероксидаза может проявлять не только пероксидазные, но и оксидазные свойства, окисляя ряд соединений с участием неактивного молекулярного кислорода. Многие пероксидазы обладают ауксиноксидазной активностью и могут регулировать уровень ауксинов в растительной клетке.
Пероксидазы характеризуются множественностью молекулярных форм. Их изозимный набор состоит из кислых, нейтральных и щелочных форм. Изопероксидазы различаются по активности катализа реакций окисления различных субстратов, что существенно расширяет возможности энзима.
Пероксидазная активность может индуцироваться в ответ на действие тяжелых металлов и других токсичных веществ. Возможно, растения, по крайней мере, водные
(Nymphaea) могут использовать пероксидазы для продуцирования фенольных полимеров, связывающих в специальных железах кадмий (Cd) в комплексные соединения. Увеличение активности пероксидазы отмечено также в ответ на атмосферные и почвенные загрязнения. He случайно пероксидазная активность рассматривается в качестве чувствительного теста для оценки степени загрязнения окружающей среды.
Некоторые оксидазы содержат в активном центре два микроэлемента: железо в виде тема и медь. В составе дыхательной ЭТЦ подобные оксидазы катализируют восстановление молекулярного кислорода до молекулы воды с использованием в качестве источника электронов цитохрома с или хинона. В непосредственном связывании кислорода участвует биядерный центр (Fe/Cu), в котором медь связана с гемом тремя лигандами гистидина. Некоторые гем/Сu-оксидазы содержат в своем составе остатки тирозина, ковалентно связанные с одним из лигандов гистидина. В работе теоретические механизмы, включающие образование форм железа в высокой степени окисления, описаны более подробно.
Каталаза. Гемсодержащий фермент класса оксидоредуктаз, широко распространенный в тканях растений и животных, катализирует разложение пероксида водорода с образованием кислорода и воды:
2H2O2 → 2Н2О + О2.
В настоящее время известно два типа каталаз, содержащих гем железа и марганец. Гемовые формы каталазы обнаружены у многих организмов, тогда как Мn-каталаза — только у прокариот. Содержащие железо каталазы представляют собой тетрамер, включающий гем d с двумя ОН-группами в цис-положении. По-видимому, гем d может возникать из гема b (протогем IX). Тетрамер гемовой формы каталазы локализован в пероксисомах растений, где этот фермент участвует в обезвреживании пероксида водорода, продуцируемого в процессе фотодыхания. Вероятно, каталаза играет важную роль в защите растений от активных форм кислорода совместно с салициловой кислотой.
Hитратредуктаза. Гем- и молибденсодержащий флавопротеин катализирует восстановление нитрата (NO3-) до нитрита (NO2-):
NO3- + НАД(Ф)Н + H+ → NO2- + НАДФ + H2O.
Hитратредуктаза (HP) растений принадлежит к широко распространенному у эукариот (растений, грибов, дрожжей, водорослей) семейству ассимиляторных эукариот, относящихся к классу молибденсодержащих ферментов. В высших растениях HP - димер молекулярной массой 200-270 кД. Каждая субъединица может отдельно участвовать в восстановлении нитрата до нитрита и состоит из трех простетических групп (рис. 2.4): флавинадениндинуклеотида (ФАД, диафоразного компонента), цитохрома b557 и молибденового кофактора (Мосо).
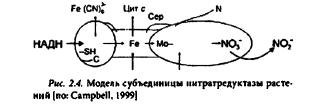
Перенос электронов от восстановленных эквивалентов — НАД(Ф)Н — к нитрату осуществляется этими простетическими группами последовательно. Для активации фермента необходима его димеризация, в результате которой возможно образование как димера, так и тетрамера (димера димеров). Hитратредуктаза грибов и водорослей использует в качестве донора электронов преимущественно НАД(Ф)Н. У эукариот и бактерий нитратредуктазы различаются структурой Mo- и Fе-содержащих частей. Бактериальный Мо-кофактор молибдоптерингуаниндинуклеотид (MGD) отличается от эукариотического дополнительным нуклеотидом. Бактериальные HP характеризуются в качестве переносчиков электронов железосерными [4Fe*4S], тогда как HP эукариот — Fe-гемовыми окислительно-восстановительными центрами. Диафоразная часть фермента термолабильна и не подвержена окислительно-восстановительным превращениям. Терминальная часть HP устойчива к нагреванию, ее активность подавляется металлсвязывающими ингибиторами и регулируется окислительно-восстановительными реакциями.
Hитратредуктаза относится к полифункциональным ферментам с несколькими окислительно-восстановительными центрами, участвующими в восстановлении различных субстратов. Простетическая группа ФАДН; восстанавливает не только нитраты, но также Fe(III) в форме цитрата или цианида. Скорость восстановления железа составляет примерно 5% от скорости восстановления нитрата. Допускается возможность участия HP в восстановлении комплексов железа с сидерофорами, синтезируемыми микроорганизмами.
По-видимому, можно выделить два этапа синтеза фермента в растениях: синтез полипептидных цепей субъединиц фермента и присоединение к неактивному предшественнику HP молибдокофактора. При недостатке молибдена в растениях содержится много предшественников HP, которые не содержат молибдена и не обладают нитратредуктазной активностью. Под действием молибденовых удобрений формируются активные формы HP. Дефицит молибдена, а также железа в среде способствует существенному подавлению активности энзима и повышению содержания нитратов в растениях.
В растениях может находиться несколько конститутивных форм HP. У сои обнаружены три изоформы HP: две конститутивные с оптимумом pH 6,5 и одна нитратиндуцибельная с оптимумом pH 7,5. При содержании в среде нитратов активность фермента многократно увеличиваемся, а аминокислот уменьшается. Индукция HP происходит на уровне мРНК. Нитраты оказывают стабилизирующее действие на HP, защищая фермент от действия протеиназ. Кроме нитратов индукцию фермента вызывают цитокинины и этилен, а также некоторые органические кислоты и сульфат аммония при pH 3,0.
В растительной клетке HP сосредоточены главным образом в цитозоле, возможно, вследствие непрочных связей с мембранами. Однако в ряде случаев выявлена связь этого фермента с ламеллярными структурами и стромой хлоропластом. Обсуждают возможность локализации фермента на мембранах эндоплазматического ретикулума и в плазмалемме.
Нитритредуктаза. Этот белок — мономер молекулярной массой 60-63 кД содержит s качестве простетических групп железо в форме связанного нековалентно гема и железосерного кластера [4Fe*4S]. В растениях, водорослях, цианобактериях нитритредуктаза (НиР) участвует в восстановлении нитрита до аммиака;
NO2 + 6Фд восст + 8Н' → NH4' + 6Фд очисл + 2H2O.
Донором электронов служит восстановленный ферредоксин (Фд). В зеленых листьях он генерируется ФС 1. В нефотосинтезирующих тканях высших растений (корнях) Фд восстанавливается НАДФ. Как показано на рис. 2.5, гемовая форма НиР непосредственно связывает нитриты.
Промежуточной формой нитритредуктазы в каталитическом цикле является ее сирогем/NO-комплекс. Этот комплекс восстановлен в большей степени (на 2 электрона) по сравнению с окисленной формой фермента, связанной с нитритом. У фотосинтезирующих эукариот этот растворимый фермент локализован в строме хлоропластов.
У многих одноклеточных организмов, включая некоторые грибы, выделена изформа НиР, содержащая медь (СиНиР). Этот фермент катализирует восстановление нитрита до оксида азота
NO2- + 2Н+ + е → NO + H2O.
Такой процесс возможен при диссимиляторной денитрификации, когда нитраты и нитриты с их метаболитами используются в качестве акцепторов электронов в условиях недостатка кислорода.
Леггемоглобин. Белок красного цвета молекулярной массой около 16 кД, содержит железо в форме тема. Образуется в клубеньках только при эффективном симбиозе с клубеньковыми бактериями родов
Rhizobium и Bradyrhizobium. Белок леггемоглобина — продукт растительного происхождения, а синтез гема частично осуществляется бактериальным симбионтом. Благодаря высокому сродству к свободному кислороду (O2) леггемоглобин создает анаэробные условия, необходимые для дифференциации бактероидов и синтеза нитрогеназы, осуществляющей фиксацию молекулярного азота. В бактероидах
В. japonicum синтез АТФ наибольший при низкой концентрации кислорода (0,02-0,1 мкмоль/л), поддерживаемой с участием леггемоглобина. Инактивацию леггемоглобина пероксидом водорода предотвращает никотиновая кислота, образующая стабильные комплексы с этим Fe-белком. Чем стабильнее никотинатный комплекс, тем продолжительнее функционирует леггемоглобик в процессах оксигенирования — деоксигенирования.
В растениях часть железа находится в составе негемовых белков. В них металл координирован в кластеры тиоловыми группами цистеина и/или неорганической серой, О- и N-лигандами. Синтез Fe-S-кластеров осуществляется в митохондриях и пластидах растений. Потенциальным донором железа для синтеза Fe-S-кластсров служит фратаксин — консервативный белок, широко распространенный у различных организмов: от бактерий до млекопитающих. Пока не ясно, может ли быть фратаксин непосредственным источником для синтеза Fe-S-кластеров в митохондриях растений. Показано, однако, что фратаксин необходим для полной активации митохондриальных Fe-S-белков.
Негемовые формы Fe-фермеитов играют важную роль в биологических системах. Железосодержащие центры этих ферментов непосредственно участвуют в активации кислорода. В координационной сфере таких белков обычно превалируют О- и N-лиганды. Известно семейство ферментов этой группы, катализирующих реакции с образованием интермедиатов железа с высокой валентностью (Fe+4, F+5): α-кетоглутарат- и плеринзависимые ферменты, Риске-подобная диоксигеназа, 1-аминоциклопропан-1-карбооксидаза и некоторые другие (рис. 2.6). У высших растений 1-аминоциклопропан-1-карбооксидаза вовлечена в синтез фитогормона этилена. Некоторые из негемовых белков участвуют в окислении серных эфиров до оксидов серы.
В целом негемовые формы отличаются от гемовых белков большей эластичностью окружения металла. Дальше приведено описание некоторых Fe-S-белков растений.
Ферредоксин. Обнаружен у цианобактерий, в хлоропластах водорослей и высших растений, представляет собой мономер белка молекулярной массой примерно 11 кД. Все ферредоксины содержат по одному кластеру [2Fe-2S]+1,+2 на одну молекулу, участвующему в переносе одного электрона при низкой величине окислительно-восстановительного потенциала: от -300 до -460 мВ. Последовательность аминокислот в этом белке хорошо изучена, в растительном ферредоксине она весьма консервативна.
Ферредоксии служит конечным акцептором электронов ЭТЦ фотосинтеза (рис. 2.7). Большая часть восстановленного ферредоксина, формирующегося в световых реакциях ФС 1, используется для восстановления НАДФ' в реакциях, катализируемых зависимой от ферредоксина HАДФ'-оксидоредуктазой. Установлены структурные особенности взаимодействия между этими двумя белками. Ферредоксии может участвовать в восстановлении до аммония нитрита как единственного источника азота, попадающего в хлоропласт. В цикле восстановления, катализируемом системой глутаминсинтетаза (ГС)-глутамин-оксоглутарат-аминотрансфераза (ГОГAT), образуются аминокислоты, используемые затем в синтезе белка в хлоропласте. Кроме того, ферредоксии восстанавливает тиоредоксин, участвующий в регуляции синтеза белка, в работе ЭТЦ и АТФ-синтазы. Электроны ферредоксина вовлечены в процесс восстановления сульфатов, а также кислорода.
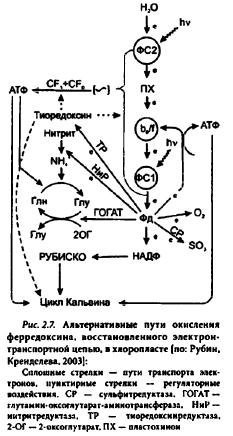
Ферредоксии участвует в регуляции распределения электронов между их нециклическими и циклическими потоками, однако пути и механизмы такого транспорта электронов до сих пор дискутируются.
Нитрогеназа. Ключевой фермент, катализирующий фиксацию молекулярного азота у азотфиксирующих микроорганизмов (аэробных и анаэробных бактерий, цианобактерий), корневых клубеньков бобовых и небобовых растений. Состоит из двух негемовых белков: Fe-белка и Mo-Fe-белка (рис. 2.8). Fe-белок состоит из двух субъединиц и одного Fe- S-кластвра [4Fe-4S]. Этот белок участвует в связывании MgAT-Ф и транспорте электронов к Mo-Fe-белку. Молекулярная масса Mo-Fe-белка составляет примерно 230 кД, он состоит из четырех субъединиц и участвует в непосредственном связывании азота.
Нитрогеназа катализирует три сопряженных реакции: восстановление субстратов (N2, C2H2 и др.), гидролиз АТФ и АТФ-зависимое выделение водорода:
N2 + 8Н+ + 8e + 16Mg - АТФ → 2NH3 + H2 + 16Mg - АДФ + 16 Р.
Связывание и восстановление азота осуществляется на Mo-Fе-белке (рис. 2.9). Этап протонировамия молибдена является необходимым для связывания азота, в результате которого выделяется молекулярный водород. В расщеплении Н2 до 2Н+ и 2 е+ принимает участие нитрогеназа (гидрогеказная функция нитрогеназы). Часть этих электронов расходуется на N2-фиксацию. В отсутствие субстрата (N2) преобладающим продуктом реакции становится водород. Даже в оптимальных для N2-фиксации условиях 25% электронов, транспортируемых через нитрогеназу, направлено на образование молекулярного водорода.
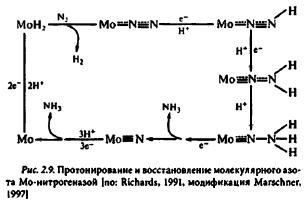
Кроме молекулярного азота нитрогеназа восстанавливает некоторые соединения с тройной связью: азиды, цианиды, ацетилен и др. По окончании элементарного каталитического акта окисленная форма Fе-белка диссоциирует от Мо-Fе-белка. Этот этап рассматривают как стадию, лимитирующую работу нитрогеназы — одного из наиболее медленно работающих ферментов бактериальной клетки. Низкая скорость работы фермента компенсируется интенсивным синтезом его молекул: до 20% общего белка клетки. В защите нитрогеназы бактероидов от необратимой инактивации кислородом важная роль принадлежит леггемоглобину.
Супероксиддисмутаза. Относится к семейству металлоферментов, катализирующих дисмутацию свободных супероксидиых радикалов (O2-):
2О2- + 2Н+ → H2O2 + O2.
Некоторые изозимы супероксиддисмутазы (СОД) содержат железо в качестве простатической группы (FeCOД). Этот изозим обычен в клетках простейших, но может находиться в растениях, главным образом в хлоропластах, а также в митохондриях и пероксисомах. Дисмутация ГеСОД происходит с непосредственным участием железа:
Fe3+ + О2- → Fe2+ + O2
Fe2+ + O2- + 2Н+ → Fe3+ + H2O2.
Кроме железа СОД может содержать медь, цинк или марганец. Активные формы кислорода токсичны и могут повреждать различные компоненты клеток, например, инициировать пероксидное окисление липидов мембран, что приводит к их дезинтеграции и повышению проницаемости. С образованием супероксидных радикалов связаны многие патологические процессы в растениях, обусловленные инфекционными заболеваниями, действием гербицидов, ксенобиотиков, неблагоприятных экологических факторов и механических повреждений. Влияние свободных радикалов ограничивается действием естественных антиоксидантов, содержащихся з тканях растений, и работой ферментов, главным образом СОД.
Аконитаза. Железо-серный белок, катализирующий изомеризацию цитрата до изоцитрата в цикле трикарбоновых кислот. Железо, компонент негемовой простетической группы, необходимо для стабилизации и активации фермента. Fe-кластср аконитазы отвечает за пространственную ориентацию субстратов (цитрат-изоцитрат). При этом катализ не сопровождается изменением валентности железа.
Ксантындегидрогеназа/оксидаза. Металлофлавопротеин молекулярной массой 300 кД, состоящий из двух субъединиц. В каждой субъединице три четко выраженных домена:
1) N-термииальный домен массой 20 кД, связывает два кластера [2Fe-2S];
2) домен массой 40 кД — место связывания ФАД;
3) С-терминальный домен, необходимый для связывания Мо-кофактора (Мосо).
Электроны, образующиеся при окислении субстрата, транспортируются либо на
НАД+, который трансформируется в НАДН, либо на молекулярный кислород, который трансформируется в супероксидныс анионы. Ксантиндегидрогеназа характеризуется высоким сродством к ксантину и гипоксантину и более низким сродством к пуринам и птеринам. Вовлечена в катализ уреидов и катаболизм пуринов. Обнаружена в различных растительных организмах и тканях, включая клубеньки бобовых растений.
Наибольшая активность фермента отмечена в клубеньках бобовых культур, где она в 500-1000 раз выше, чем в листьях бобовых и других растений. В зависимости от транспортных форм связанного азота бобовые растения делятся на два класса: транспортирующие азот в форме амидов: глутамина, аспарагина, и уреидов: аллантоина и аллантоиновой кислоты. Транспорт в форме уреидов энергетически выгоднее транспорта в форме амидов. Катаболизм пуринов происходит следующим образом: гииоксантин → ксантин → мочевая кислота → аллантоин → аллантоиновая кислота. В этом процессе ксантиндегидрогеназа катализирует первые две стадии.
Фермент может работать как НАДН-ксантиноксидаза с молекулярным кислородом в качестве акцептора электронов. В этом случае ксантиндегидрогеназа может продуцировать кислородные и супероксидные радикалы, что было отмечено в случае воздействия на растения патогенных организмов, в условиях засухи и при естественном старении организмов.
Клеточная локализация ксаитиндегидрогеназы пока слабо изучена. Она обнаружена в цитозоле и пероксисомах.
Липоксигеназы. Содержат один атом негемового железа на одну молекулу. Семейство этих ферментов, относящихся к группе оксидоредуктаз, широко распространено в царствах растений и животных. Липоксигеназы катализируют присоединение молекулярного кислорода к ненасыщенным жирным кислотам, что сопровождается образованием гидропероксидов жирных кислот. Линолевая и линоленовая кислоты — наиболее типичные субстраты липокигеназ в растениях. Высокая липоксидазная активность, типичная для быстрорастущих органов и тканей, может быть критичной для стабильности мембран. Пероксидное окисление липидов вовлечено в процесс старения клеток и тканей, а также в реакции устойчивости растений к действию патогенных микроорганизмов.
В растениях липоксигеназы локализованы главным образом в цитозоле и вакуолях. Изозимы липоксигеназы обнаружены также в хлоропластах и жировых телах. Кроме того, липоксигеназы могут ассоциироваться с мембранами: плазматическими, тилакоидными и др. Недавно с помощью биохимических и иммунохимических методов обнаружены две изоформы липоксигеназы в митохондриях клеток, выделенных из стеблей гороха. Физиологическое значение такой локализации липоксигеназ пока не установлено. В клетках млекопитающих содержание липоксигеназ в митохондриях ассоциируется с деградацией последних. У растений содержание липоксигеназ в митохондриях, возможно, связано с запуском программы апоптоза, что приводит к деградации этих органелл.
Ферритин. Запасающий железо белок. На одну макромолекулу ферритииа кукурузы, бобов и соевых бобов приходится соответственно 990, 1800 и 2500 атомов железа. Вновь образованный белок, не содержащий железа, называется апоферритин. Покрывающая ядро белковая оболочка состоит из 24 глобулярных субъединиц, каждая молекулярной массой 18,5-21,0 кД. Молекулярная масса нативного апоферритина составляет 480-510 кД. Субъединицы апоферритина формируют центральную полость диаметром 5-8 нм, которая загружается ионами Fe2+. В этой полости железо концентрируется и кристаллизуется в гидроксид Fe3+. Ферритин сохраняет железо в окисленной форме, которая, d отличие от его остановленной формы, не катализирует продукцию свободных радикалов кислорода в реакции Фентона: Fe2+ + H2O2 → Fej+ + ОН + ОН.
Структура белковой глобулы феррритина консервативна, тогда как железосодержащего ядра вариабельна, особенно по содержанию неорганического фосфора. Выход железа из молекулы ферритииа осуществляется через поры в белковой оболочке и сопровождается восстановлением Fe3+ до Fe2+.
Ферритин в листьях локализуется главным образом в не содержащих хлорофилл пластидах: этиопластах и амилопластах. Аккумуляция ферритина происходит в строме пластид; в их сухой массе накапливается до 12-23% железа. Небольшое количество ферритииа находится в зрелых хлоропластах, в основном в листьях (особенно в базальной и верхушечной частях) молодых растений. На более поздних стадиях развития листьев ферритин в зрелых хлоропластах не выявлен. По-видимому, на ранних стадиях развития растений ферритин служит источником железа для фотосинтеза. В стареющих тканях ферритин может вновь синтезироваться. Механизм синтеза ферритииа в зависимости от стадии развития листьев не изучен. He выявлено прямой связи между содержанием в листьях ферритина и уровнем мРНК. В высших растениях ферритин идентифицирован также в цитозоле и митохондриях.
В корнях ферритин выявлен в пластидах. У Arabidopsis высокий уровень экспрессии ответственных за синтез ферритина генов AtFerl приурочен к эндодерме кончиков корней. Ферритин — своеобразный буфер между железом, сосредоточенным в эпидерме, и железом в коре корня.
В клубеньках бобовых растений ферритин служит источником железа для синтеза нитрогеназы и леггемоглобина. С началом фиксации азота и соответственно увеличением потребности растений в железе концентрация ферритииа в клубеньках уменьшается. Этилен, как и избыток железа, стимулирует синтез ферритина в пластидах. Экспрессия генов, ответственных за синтез ферритина, возрастает в условиях избыточного содержания в среде железа и окислительного стресса (обработка Н2О2). Предполагают, что механизмы воздействия этих факторов на экспрессию генов разные.
Роль ферритина в регуляции у растений окислительно-восстановительных реакций с участием железа особенно важна в стрессовых условиях. Обнаружено накопление ферритина в хлоропластах мезофилла первичных листьев у галофита хрустальной травки
(Mesembryanthemiim crystallinum) при засолении и совместном действии засоления с экзогенным путресцином. Аккумуляция ферритииа коррелирует с повышением активности антиоксидантных ферментов. Отмечено возрастание не только количества ферритина, но и содержания в нем железа: Fe-содержащие ядра увеличены по сравнению с контролем в два-три раза. Скопление ферритина свойственно клеткам обкладки хлоропластом сопровождающим клеткам флоэмы и другим паренхимным клеткам тонких окончаний листа. Обнаружение ферритина в ситовидных элементах флоэмы, по-видимому, свидетельствует в пользу возможности транспорта железа в форме ферритина между органами растений.
В клетках околососудистой паренхимы листьев хрустальной травки отмечены признаки разрушения и превращения ферритина в метаболически неактивную гидрофобную форму — фитосидерин. В клетках обкладки фитосидерин обнаружили не только в хлоропластах, но и с вакуолях, везикулах, прилегающих к пластидам и митохондриям, а также в цитозоле и инвагинациях фрагментов цитоплазмы, отпочковывающихся в вакуоль. Возможно, клетки обкладки участвуют в транслокации Fe-содержащих молекул из мезофилла в паренхиму тонких окончаний — буферную зону, поддерживающую определенную концентрацию железа в мезофилле листа. Превращение ферритина в фитосидерин в паренхиме сосудов может быть эффективным способом выведения избытка активных форм железа из метаболизма клетки и снижения тем самым интенсивности окислительного стресса. Индукция трансформации ферритина происходит, по-видимому, в хлоропластах, а его последующий протеолиз и запасание в виде фитосидерина — в вакуоли.
Участие в фотосинтезе. В тилакоидных мембранах хлоропластов около 20 атомов железа в расчете на каждый пигмент ФС 1 и ФС 2 непосредственно вовлечены в ЭТЦ. Такая высокая потребность в железе необходима для структурной и функциональной интеграции этих мембран, а также для обеспечения биосинтеза ферредоксина и хлорофилла (рис. 2.10).
Неслучайно хлоропласты а целом и тилакоидные мембраны в частности характеризуются высокой чувствительностью к недостатку железа. Низкую концентрацию хлорофилла в молодых листьях (хлороз) относят к типичным симптомам Fe-дефицита у высших растений.
Идентифицированы три железосерных белка, участвующие в переносе электронов с акцепторной стороны ФС 1. Расстояние между пигментом П700 ФС 1 и этими Fe-S-центрами соответствует толщине мембраны, т. е перенос электронов на этом участке ЭТЦ трансмембранный. Феррелоксин — следующий за ФС 1 компонент ЭТЦ хлоропластов. В расчете на один каталитический центр этот белок содержит два или четыре атома железа и четыре атома серы. Этот белок участвует не только в переносе электронов, но и в формировании структуры белковой глобулы. Следующий Fe-содержащий компонент линейной цепи фотосинтеза — ферредоксин-НАДФ-редуктаза. Этот фермент включает в себя ФАД в качестве простетической группы. В молекуле этого фермента ферредоксин связывается основными аминокислотными остатками. Восстановленный НАДФ и синтезированная в процессе фосфорилирования, сопряженном с транспортом электронов, АТФ обеспечивают восстановление CO2 в цикле Кальвина.
Цитохромный комплекс b/f участвует в передаче электронов от ФС 2 к ФС 1. В целом ФС 1 страдает от недостатка железа большей степени, чем ФС 2.
Участие в цветении. Железо необходимо для нормального цветения высших растений. У мутантов табака с нарушенным синтезом никотинамина формировались цветки, в которых было больше по сравнению с диким видом увеличенных чашелистиков и меньше пыльцы. Признаки ненормального цветения исчезали после экзогенной обработки мутантов комплексом никотинамина с железом. Контроль транспорта никотинаминовых комплексов железа осуществляется с участием генов YSL. У арабидопсиса экспрессия генов этого семейства (AtYSLl) зафиксирована в различных частях цветков: цветоножках, чашелистиках, лепестках, незрелых пыльниках, нитях зрелых тычинок, а сосудистой системе пестика. Семейство генов ОРТ, кодирующих синтез транспортеров металлов, также может участвовать в генетической регуляции цветения с участием железа.
Содержание. Содержание железа в растениях больше, чем других металлов-микроэлементов. Обычно его концентрация в корнях в несколько раз выше, чем в побеге. Среднее содержание железа в растительности континентов — 200 мг/кг. В Забайкалье (Россия) средняя концентрация железа в степной растительности составляет 182 (колебания 82-280) мг/кг, в злаковой растительности лугов — 130 (56-195), в разнотравной — 164 (58-330), осоковой 142 (64-225), в злаковой растительности культурных ценозов 123 (33-183), в растениях рапса — 301 (214-435) мг/кг. Норма железа в кормах для жвачных животных — 50-80 мг/кг, а максимально допустимый уровень — 400 мг/кг.
В хлоропластах локализуется около 80% железа, находящегося в листьях. Большая часть железа сосредоточена в тилакоидах. В тилакоидных мембранах около 20 атомов железа в расчете на единицу ФС 2 и ФС 1 непосредственно включены в ЭТЦ. Столь высокая потребность в железе необходима для структурной и функциональной интеграции мембран. В связи с этим функционирование хлоропластов в целом и тилакоидов в частности зависит от обеспеченности растений железом.