Формы и функции цинка в растениях
Необходимость цинка растениям впервые показана в опытах с кукурузой, а затем с ячменем и карликовым подсолнечником. В растениях цинк находится только в двухвалентной форме и не принимает участия в окислительно-восстановительных реакциях. Метаболические функции цинка основываются на способности этого металла формировать тетраэдрические комплексы с N-, О-, и S-лигандами и таким образом играть ключевую роль а ферментативных реакциях, выполняя при этом каталитическую и структурные функции. В ферментах, где цинк выполняет каталитическую функцию (карбоангидраза, карбоксипептидаза), этот металл координируется четырьмя лигандами (рис. 2.11, а).
Три лиганда представлены аминокислотными остатками (гистидин, глутамин, аспарагин), а четвертый — молекулой воды. Следовательно, имеется место, необходимое для выполнения цинком каталитических функций. В белках, где цинк выполняет структурную функцию (алкогольдегидрогеназа), атомы цинка координированы S-группами четырех остатков цистеина (рис. 2.11, б).
Цинк — составная часть многих ферментов, играющих важную роль в разнообразных метаболических реакциях. Примеры некоторых Zn-содержащих ферментов представлены дальше.
Карбоангидраза. Содержит в своем составе цинк и катализирует следующую реакцию:
CO2 + H2O ↔ НСО3- + Н+.
В этой реакции атом цинка связывает ион ОН- и взаимодействует с молекулой CO: для образования Zn-связанной формы HCO-:
ЕZn2+ОH- + CO2 + H2O ↔ EZn2+H2O +НСО3-,
EZn2+H2O + B ↔ ЕZn2+OH- + BH+.
где E — фермент, В — молекула буфера.
Смещение равновесия в этой реакции зависит от значений pH; при значениях pH ниже первой константы диссоциации Н2СО3 (pK4 = 6,4) доминирует CO2, в диапазоне pH от 6,4 до 10,3 (pK2) — HCO3-, при значениях pH выше 10,3 — формы CO3в2-.
Различают три типа карбоангидраз: α-, β- и γ-карбоангидразы. Карбоангидразы первого типа обнаружены у различных организмов: животных, растений, бактерий и вирусов, хотя в целом они больше характерны для животных. Менее изучены карбоангидразы β-типа, обнаруженные только в растениях и эубактериях. Карбоангидразы α-типа представляют собой мономер с молекулярной массой 30 кД. Атом цинка в этом белке координирован атомами азота трех гистидиновых остатков. Карбоангидразы β-типа — олигомеры молекулярной массой от 140 до 220 кД у двудольных и меньшей массой (около 100 кД) у однодольных растений. Карбоангидразы γ-типа обнаружены как у бактерий, так и у растений. Выделенные из бактерий
Meihanosarcina termophilia γ-карбоангидразы состояли из трех субъединиц, содержащих по одному атому цинка.
В растениях наиболее изучена роль карбоангидраз β-типа, которые могут участвовать в различных реакциях карбоксилирования/декарбоксилирования. Молекула растительной карбоангидразы содержит большое количество SH-групп цистеина и метионина. Активные центры каждого из двух мономеров карбоангидразы гороха расположены на поверхностях их соприкосновения. Связь атома цинка с апоферментом осуществляется через имидазольное кольцо His220. Двумя другими координационными связями цинк связан с Суs160 и Cys223. В растениях локализована в хлоропластах и цитозоле. Встречается также в плазма лемме, хотя функциональное значение карбоангидразы такой локализации не понятно. Возможно, плазмалемная карбоангидраза — рудиментарное образование или ее роль связана не с процессами фотосинтеза, а с другими процессами в клетке. Предшественник хлоропластной (стромальной) формы фермента транспортируется в хлоропласты, где участвует в процессинге.
Карбоангидразы β-типа широко представлены в строме хлоропластов C3-растений, где их доля составляет 0,5-2% от содержания растворимых белков в листьях. Однако тесная связь между фотосинтезом и активностью карбоангидразы наиболее четко обнаруживается у С4-растений. В трансгенных растениях табака подавление на 98-99% активности карбоангидразы не отражалось на активности фотосинтеза, рассчитанной на единицу поверхности листа. Различия обусловлены тем, что у С3-растений (пшеница, рис, соя) основным субстратом для РБФ-карбоксилазы служит CO2, а у С1-растений (кукуруза, сорго) субстрат для ФЕП-карбоксилазы — HСО3-, В растениях без участия карбоангидразы может пополняться внутриклеточный уровень CO2 в отличие от бикарбоната. В листьях газообразная форма CO2 не только довольно легко проникает в пространство под устьицами, но и выходит из него. Вот почему недостаток цинка негативно сказывается на скорости фотосинтеза у C4-растений.
Вопрос о функциях карбоангидразы С3-растений пока остается дискуссионным. Возможно, этот фермент, регулирующий приток бикарбоната в комплексе ФС 2. необходим для нормализации в этой фотосистеме транспорта электронов. Кроме того, карбоангидраза может участвовать в защите ФС 2 от фотоингибирования в условиях интенсивного освещения путем связывания избытка протонов. Процесс сопровождается образованием незаряженной молекулы CO2, хорошо растворимой в липидной фазе. Карбоангидраза в тилакоидных мембранах ФС 1 может участвовать в транспорте CO2 к РБФК/О, находящейся в контакте с мембранами стромы, где расположена ФС 1.
Цинк — конститутивная часть и других ферментов, вовлеченных в фотосинтез, например рибулозобисфосфаткарбоксилазы. Этот фермент участвует в первой стадии фиксации CO2.
Дегидрогеназы. Цинк входит в состав множества дегидрогеназ: алкогольдегидрогеназы, глутаминдегидрогеназы, D-длицеральдегид-3-фосфатдегидрогеназы и др. Алкогольдегидрогеназа, например, содержащая два атома цинка на молекулу, катализирует восстановление ацетальдегида до этанола:
В аэробных условиях образование этанола происходит главным образом в меристемах. Анаэробные условия в сочетании с Zn снабжением стимулируют активность фермента, локализованного в корнях. Дегидрогеназы играют важную роль в метаболизме растений, участвуя в разнообразных окислительно-восстановительных реакциях.
Супероксиддисмутаза. Изофермент СОД (CuZnCOД) молекулярной массой около 32 кД содержит по одному атому цинка и меди, соединенных через общий азот гистидина. Атом меди непосредственно вовлечен в катализ реакций дисмутации супероксидного радикала:
O2 - + Cu(II)ZnCOД → О2 + Cu(I)ZnCOД;
O2+ + Cu(I)ZnCOД + 2Н+ → H2O2 + Cu(II)ZnCOД.
Цинк в этой реакции поддерживает конфигурацию активной части фермента и облегчает стадию окисление. Кроме того, CuZnCOД может действовать как пероксида за, окисляя различные органические субстраты, а также нитриты. Однако в присутствии H2O2 фермент инактивируется, вероятно, вследствие восстановления Cu2+. В растениях CuZnCOД локализована в цитозоле и митохондриях, глиоксисомах, может находиться и в хлоропластах совместно с FeCOД.
Белки «цинковые пальцы» (zinc finger proteins). Играют ключевую роль в различных клеточных процессах, включая регуляцию транскрипции, связывание РНК, регуляцию апоптоза, взаимодействия между белками. Некоторые белки этого класса могут связывать только ДНК, другие — ДНК и РНК или только РНК. Роль цинка сводится к стимуляции связывания белков этого типа с нуклеиновыми кислотами. Из растений гороха выделен белок PLATZl (plant AT-rich sequence-and zinc-binding protein I). Неспецифическое связывание этим белком ДНК происходило в присутствии цинка, что было доказано экспериментально с использованием 1,10-фенантролина в качестве Zn-хелатирующего агента. Предполагают, что гены PLATZl имеют отношение к клеточному делению или регуляции дифференцирован клеток, предшествующей этому процессу.
В обсуждаемом классе белков выделяют несколько типов в зависимости от числа и порядка остатков цистеина и гистидина к молекуле, участвующих в связывании ионов цинка во вторичной структуре «цинковых пальцев». Наиболее изученные и представительные среди эукариот семейства, относящиеся к тину С2Н2: Cl, Cl-li, AZF1, AZF2, AZF3, Zat6. Эта группа белков необходима для транскрипции процессов регуляции и развития организмов, их защиты от патогенов и стрессовых воздействий. В растениях риса (Oryza saliva) обнаружено 189 белков — представителей этих семейств, из них 26 белков участвуют в стрессовых реакциях.
Между белками разных семейств возможны взаимодействия. Например, в трансгенных растениях экспрессия генов, участвующих в синтезе белков Zat7, увеличивав толерантность растений к холоду, снижала их толерантность к осмотическому стрессу. По-видимому, в условиях стресса активируется множество «цинковых пальцев» одновременно.
Выявлено несколько содержащих цинк ферментов, имеющих отношение к транскрипции и участвующих в синтезе нуклеиновых кислот: РНК- и ДНК-полимеразы, гистондиацетазы и др. В настоящее время не вызывает сомнения необходимость цинка для метаболизма и модификации нуклеиновых кислот в пластидах и митохондриях.
В цитоплазме цинк играет важную роль в процессах трансляции и как кофактор РНК-синтетаз. В растениях кукурузы идентифицирован фактор elF-5, который инициирует трансляцию и связывается с РНК, если взаимодействие с цинком осуществляется по принципу действия «цинковых пальцев». Трансляция в митохондриях и хлоропластах меньше зависит от присутствия цинка. В бактериях при недостатке цинка отмечено замещение Zn-зависимых белков трансляционного аппарата на Zn-независимые.
Другие ферменты, содержащие цинк. Цинк является компонентом многих других ферментов: щелочной фосфатазы, фосфолипазы, РНК-полимеразы и др. В состав двух первых ферментов входят по три атома цинка, по крайней мере один из них обладает каталитической функцией. РНК-полимераза содержит по два атома цинка на молекулу.
Активируемые цинком ферменты. Цинк активирует множество ферментов: дегидрогеназы, альдолазы, изомеразы, трансфосфорилазы. Например, этот микроэлемент необходим для активации двух ключевых ферментов углеводного обмена — фруктозо-1,6-дифосфатазы и альдолазы. Оба фермента локализованы в хлоропластах и цитозоле. Фруктозо-1,6-дифосфатаза регулирует превращение С4+ сахаров в хлоропластах и цитоплазме, а альдолаза — перемещение С3-фотосинтатов из хлоропластов в цитоплазму и трансформацию метабол птоз в цитоплазме гликолитическим путем. Важным компонентом протонной помпы в тонопласте являются неорганические пирофосфатазы (ПФазы). Кроме хорошо известной Mg-зависимой пирофосфатазы (Mg-ПФаза), в листьях существует изозим, активируемый цинком (Zn-ПФаза). У риса соотношение Мg-ПФаза/Zn-ПФаза варьирует от 3 до 6.
Белковый синтез. Цинк тесно связан с белковым синтезом. Этот металл — структурный компонент рибосом. Содержание цинка в рибосомальной РНК обеспеченных цинком клеток Euglena колеблется в диапазоне 650-1260 мкг/г РНК. тогда как при недостатке цинка — в диапазоне 300-380мкг/г РНК. В отсутствие данного элемента наблюдается структурная дезинтеграция рибосом. В меристемах побегов риса и в тканях табака дезинтеграция рибосом 80S происходит, когда содержание цинка становится ниже 100 и 70 мкг/г сухой массы соответственно. Влияние цинка на белковый синтез может осуществляться через регуляцию активности РНКазы, существенно возрастающей в условиях Zn-дефицита. Цинк защищает РНК от атак этого фермента. Причем повышение активности РНКазы может опережать появление симптомов недостатка цинка у растений. В связи с важной ролью цинка в белковом синтезе высокие концентрации этого микроэлемента необходимы в меристематических тканях, где активно происходит деление клеток и осуществляется синтез нуклеиновых кислот и белка. Основная роль цинка в белковом синтезе связана с его влиянием на стабильность и функционирование генетического материала.
Необходимость цинка доказана и для процесса деградации белков, в частности транскрипционных факторов, о темноте. Zn-зависимыми белками могут быть протеазы, играющие важную роль в протеолитическом процессе. Они вовлечены в импорт белков в хлоропласта, а также в процесс разрушения белков, вызываемый повреждающим действием света. Некоторые белки-переносчики, локализованные во внутренней мембране митохондрий, после выполнения транспортных функций разрушаются Zn-зависимыми протеолитическими ферментами. В случае избыточной аккумуляции транспортных белков возможно нарушение функционирования митохондрий.
Обмен индолилуксусной кислоты. Цинк связан с метаболизмом ауксинов: в условиях дефицита цинка в тканях растений снижается уровень индолилуксусной кислоты (ИУК). Уменьшение содержания ИУК может быть обусловлено как нарушениями ее синтеза, так и деградацией ИУК. Предшественником ИУК выступает триптофан. Однако сведения о необходимости цинка для его синтеза противоречивы. Отмечены факты как увеличения, так и уменьшения содержания триптофана в условиях Zn-стресса. Низкая концентрация ИУК в тканях при дефиците цинка, скорее всего, обусловлена окислительной деградацией ауксинов (рис. 2.12).
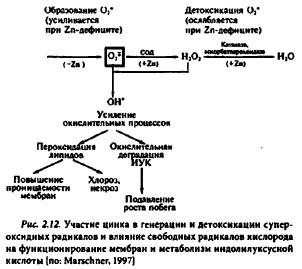
По некоторым данным, рецептором ИУК является ауксинсвязывающий белок ABP1 (auxin-binding protein 1). В результате структурных исследований установлено, что часть АВР1, непосредственно участвующая в связывании ИУК, содержит цинк. Он координируется остатками гистидина и глутаминовой кислоты, при этом одно координационное место остается свободным. Когда белок не может связывать ауксин, это координационное место заполнено молекулой воды. Белок ABP1 не обладает никакой ферментативной активностью.
Интеграция мембран. Цинк как структурный компонент биологических мембран играет важную роль в их интеграции. Повышение проницаемости мембран — типичный признак Zn-дефицита у растений. Утечка 32P из корней Zn-дефицитных растений пшеницы происходила в большей степени, чем из корней Zn-обеспеченных растений. Аналогичный эффект обнаружен в отношении утечки из корней аминокислот и углеводов. Цинк может связываться с фосфолипидами и сульфгидрильными группами мембран, формировать тетраэдрические комплексы с цистеиновыми остатками полипептидных цепей и таким образом влиять на проницаемость мембран и защищать липиды и белки от окислительной деструкции.
Содержание. Известно, что содержание цинка, как и других элементов питания, сильно зависит от условий среды и генотипических особенностей растений. Концентрация цинка в растениях обычно колеблется в диапазоне 1-80 мг/кг сухой массы. Высоким содержанием цинка отличаются лишайники и хвойные растения. Повышенное содержание цинка отмечается в таких органах растений, как листья, генеративные органы и точки роста. Концентрация цинка, в отличие от концентрации марганца, а также магния и кальция, в меристемах листьев в пять-десять раз выше, чем в листовой пластинке зрелых листьев. В главном корне люпина белого цинк равномерно распределен между корой и центральным цилиндром. Большая часть (67%) поглощенного корнем 65Zn транспортируется а побег. В зрелых кластерных корнях концентрация цинка меньше, чем в корнях молодых или средних по возрасту растений люпина белого.