Биохимия фиксации азота (часть 4)
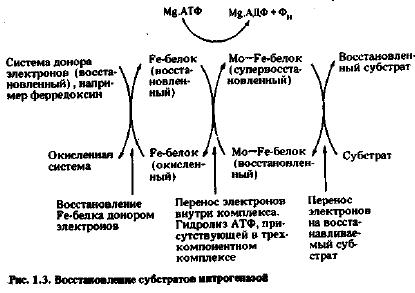
Хотя механизм фиксации азота нитрогеназой изучен пока недостаточно, есть основания полагать, что Mo—Fe-белок реагирует с потенциальными субстратами ннтрогеназы, т.е. N2 и C2H2, вероятно, путем взаимодействия восстанавливаемого субстрата с атомами молибдена белка. Fe-бeлок с меньшей молекулярной массой связывает АТФ в виде мономагниевой соли и становится более мощным восстановителем, принимая электроны от физиологической электрон-донорной системы. Находясь в таком восстановленном состоянии, Fе-белок может довести до наиболее восстановленного состояния Mo-Fe-белок. Схематически процесс фиксации включает восстановление атомов Fe в железосодержащем белке с меньшей молекулярной массой, вследствие чего АТФ гидролизуется с образованием АДФ и Фн. Электрон атомов железа в Mo-Fe-белке используется затем для восстановления связанного с последним субстрата. Должно произойти несколько таких переносов электронов, прежде чем фермент высвободит конечный восстановленный продукт (NН3, если субстратом служит N2). При каждом переносе электрона от Fe-белка на Mo-Fe-бeлок АТФ гидролизуется до АДФ. Общая схема этого процесса восстановления показана на рисунке 1.3.
Регуляция нитрогеназы. С точки зрения расходования биологической энергии нитрогеназу следует считать неэкономичным ферментом, поскольку для поддержания ее активности необходимо постоянное и обильное снабжение АТФ. Поэтому фиксирующие азот организмы выработали способы регуляции синтеза и активности нитрогеназы. Способностью фиксировать азот управляет набор генов, известных как гены фиксации азота (nif). У свободноживущих бактерий образование NH4+ при участии нитрогеназы сопряжено с процессами клеточного биосинтеза и NH4+ практически не выделяется в окружающую среду. При наличии в окружающей среде связанного азота, например NH4+ или NO3-, который может служить источником этого элемента для ростовых процессов в клетке, nif-гены репрессированы и нитрогеназа не образуется.
Напротив, у таких симбиотических бактерий, как Rhizobium, nif-гены в норме дерепрессированы, в результате нитрогеназа образуется и сохраняет активность лаже в присутствии аммония и фиксированный азот экспортируется во внешнюю среду (в случае Rhizobium — в цитоплазму клеток хозяина). В этой симбиотической ассоциации дерепрессия генов nif приводит к фиксации больших количеств атмосферного азота и играет ключевую роль в пищевых цепях, обеспечивающих потребности человечества. Другим способом регуляции фиксации азота в этой симбиотической системе может быть снабжение АТФ, которое, таким образом, может оказаться фактором, ограничивающим скорость этого процесса.
О регуляции активности нитрогеназы известно очень мало. В опытах in vitro было показано, что АТФ необходима для активности фермента, а АДФ, продукт использования АТФ ферментом, угнетает его активность. Прямую регуляцию активности нитрогеназы, вероятно, обеспечивает соотношение АТФ:АДФ в окружающей фермент среде: таким образом контролируется скорость восстановления субстрата ферментом. Косвенный контроль ферментативной активности может обеспечивать перераспределение электронов между связанными процессами восстановления азота и АТФ-зависимого выделения водорода: скорость выделения водорода может превышать скорость фиксации азота, что приводит к исчезновению избыточного восстановительного потенциала, особенно при снижении активности гидрогеназы, которая перехватывает в клетке электроны.