Биохимия фиксации азота (часть 5)
Аммоний, первичный продукт активности нитрогеназы, угнетает биосинтез нитрогеназы в свободноживущих бактериях, а в случае Azotobacter и Klebsiella был показан скоординированный синтез обоих белковых компонентов нитрогеназы. Есть данные, свидетельствующие о том, что в регуляции транскрипции генов нитрогеназы участвует глутаминсинтетаза - фермент, осуществляющий в клетке ассимиляцию NH4+ в глутамин:
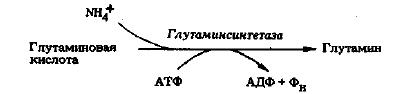
Глутаминсинтетаза существует в этих организмах в активной (деаденилированной) или неактивной (аденилированной) форме. При высоком содержании аммония клетка аденилирует глутаминсинтетазу и таким образом инактивирует ее, что приводит к выключению транскрипции генов nif. При низком содержании аммония глутаминсинтетаза деаденилируется и активируется, что вызывает транскрипцию генов нитрогеназы и, как следствие, биосинтез нитрогеназы и усиление фиксации азота. Как у Klebsiella, так и у Rhizobium содержание аденилированной (неактивной) глутаминсинтетазы связано обратной зависимостью с уровнем нитрогеназы в клетке.
Регуляция активности глутаминсинтетазы путем аденилирования фермента (ковалентное присоединение 5'-АМФ к гидроксильным группам тирозильных остатков на субъединицах глутаминсинтетазы) опосредована активностью аденилилтрансферазы (АТазы), которая катализирует реакции аденилирования и деаденилирования (рис. 1.4).

Если соответствующая регуляция реакции аденилирования и деаденилирования отсутствует, возникнет цикл, приводящий к флуктуации глутаминсинтетаз между активной и неактивной формами и бесцельному гидролизу АТФ до АДФ и Фн. Такое сопряжение предотвращается действием регуляторного белка (РБ), который присутствует в комплексе с АТазой и сам может существовать в двух взаимопревращающихся формах. Как видно из рисунка 1.4, PB стимулирует реакцию аденилирования, однако он может быть уридилирован (ковалентное присоединение остатка УМФ к белку) ферментом уридилитрансферазой (УТазой), и эта уридилированная форма стимулирует реакцию деаденилирования. Уридилирование PB и связанное с ним образование активированной формы глутаминсинтетазы стимулируется снижением содержания NH4+ в клетке и увеличением соотношения оксоглутарат/глутамин. Следствием такой стимуляции реакции деаденилирования в условиях, когда клетке необходимо увеличить снабжение фиксированным азотом, является дерепрессия генов nif и последующее образование нитрогеназы, что позволяет клетке увеличить скорость фиксации азота. Напротив, уридилирование PB с образованием РБ-УМФ угнетается при высокой концентрации NH4+ в клетке и низком значении отношения оксоглутарат/глутамин; в этих условиях в клетке увеличивается доля инактивированной глутаминсинтетазы, в результате чего выключаются гены nif и в конечном итоге снижается активность нитрогеназы в клетке и скорость фиксации азота.
Пути регуляции биосинтеза нитрогеназы глутаминсинтетазой показаны на рисунке 1.5. Существуют и другие способы клеточного контроля над экспрессий генов nif у свободноживущих азотфиксаторов, например Klebsiella. Известно, что кислород также подавляет биосинтез нитрогеназы, однако глутаминсинтетаза не служит посредником в этой репрессии.