Влияние свойств почвы на дефицит микроэлементов
Минералогический и гранулометрический состав почвы. Известные микроэлементы большей частью приурочены к тонкодисперсным фракциям почв и материнских пород. В отличие от грубых тонкие фракции обогащены так называемыми глинистыми минералами, аккумулирующими значительные количества микроэлементов. Первичные минералы практически не участвуют в сорбционных процессах, но служат потенциальными источниками микроэлементов. He случайно поэтому глинистые минералы рассматривают как минералогическую основу ППК. Термин «глинистые минералы» строго не определен. Обычно в почвах к глинистым минералам относят следующие группы: каолиниты, монтмориллониты, иллигы, хлориты, вермикулиты. Все они являются слоистыми алюмосиликатами. Глинистые минералы могут содержать незначительное количество микроэлементов в качестве структурных компонентов, однако основная их роль в регуляции подвижности элементов литания растений связана с высокой сорбционной емкостью, обусловленной функциональными группами и большой площадью поверхности. Способность почв поглощать катионы или анионы характеризуют с помощью понятий «емкость катионного обмена» (ЕKO) и «емкость анионного обмена» (ЕАО). С уменьшением размеров почвенных частиц ЕKO существенно возрастает. В почвах многих типов до 90% обменных катионов связано с фракцией ила. Высокая обменная емкость илистой фракции обусловлена не только большой адсорбционной поверхностью. Тонкие фракции почв, особенно верхних горизонтов, содержат много гуминовых веществ, способствующих аккумуляции микроэлементов.
Обменная емкость глинистых минералов, как правило, изменяется в следующей последовательности: монтмориллонит = вермикулит > иллит, хлорит > каолинит > галлуазит. Сорбция микроэлементов минералами группы монтмориллонита в значительной степени зависит от заряда и величины катиона. Сорбированные монтмориллонитами микроэлементы достаточно легко переходят в жидкую фазу и служат важным резервом минеральных элементов для растений. Сорбция и десорбция микроэлементов глинистыми минералами зависят от pH среды.
Подвижность многих тяжелых металлов в почве снижают цеолиты. Будучи емкими ионообменниками, цеолиты способны поглотить наиболее мобильные формы металлов и снизить их поток в побеги растений. Благодаря этому свойству цеолиты рекомендуют, например, для использования в качестве сорбентов тяжелых металлов при избыточном содержании последних в почве.
Выявлена количественная зависимость между дисперсностью субстрата и поглощением растениями элементов питания. С увеличением дисперсности субстрата концентрация в растениях многих макро- и микроэлементов существенно уменьшается. При этом воздействие частиц пылеватого песка в среднем вдвое слабее, чем глинистых. Наиболее сильно негативное влияние глинистых фракций почвы сказывается на поглощении растениями меди, цинка, марганца, кобальта и молибдена.
Оксиды и гидроксиды. Из многочисленных соединений этого типа наибольшее влияние на подвижность микроэлементов в почве оказывают оксиды железа и марганца, а также алюминия. Благодаря высокому содержанию железа и марганца в литосфере их оксиды и гидроксиды широко распространены в почвах а виде кристаллических и аморфных образований. Они формируют пленки на отдельных частицах, заполнения трещин и жилок, конкреции и включения. С помощью электронного микрозонда установлено, что многие микроэлементы концентрируются в пленках оксидов почвенных частиц Около 50% тяжелых металлов в почвах связано с гидроксидами железа.
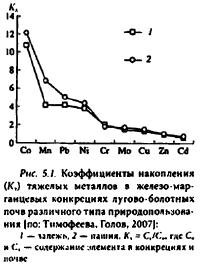
Своеобразными депонентами (ловушками) металлов в почве являются железо-маргаицевые конкреции. Стяжению в конкреции особенно подвержены следующие металлы: кобальт, марганец, свинец и никель.
Менее интенсивно стягиваются медь, хром и молибден, тогда как цинк и кадмий практически не накапливаются в конкрециях. Железо-марганцевым конкрециям лугово-болотных почв свойственно более активное накопление тяжелых металлов, чем конкрециям лугово-бурых почв залежи. В конкрециях может накапливаться до 90% почвенного кобальта, от 60 до 75% марганца и никеля, от 35 до 47% меди, свинца и молибдена, от 16 до 20% хрома и кадмия (рис. 5.1). Причем, аккумуляция в железо-марганцевых конкрециях металлов сопровождается переводом последних в труднодоступную форму. С одной стороны, это может привести к снижению в почвенном растворе концентрации тяжелых металлов, с другой, — к дефициту необходимых растениям микроэлементов.
При типичных для почвенных условий значениях реакции среды оксиды и гидроксиды заряжены положительно. Поэтому поглощение оксидами металлов не может осуществляться в результате электростатического взаимодействия, оно происходит как реакция специфической адсорбции. Механизм сорбции включает изоморфное замещение ионов железа и марганца катионами металлов-микроэлементов и окислительные эффекты на поверхности оксидов. При этом наибольшее сродство гидроксидов железа и марганца проявляется к сходным по размерам иона металлам: Co2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Pb4+, Ag'. Повышение содержания полуторных оксидов в питательном субстрате сопровождается негативными физиологическими эффектами, в частности снижением концентрации многих макро- и микроэлементов в надземных органах.
Карбонаты. В кислых почвах карбонатов практически нет, в нейтральных и щелочных их содержание составляет 15-20% и более. Почвенные карбонаты встречаются в виде метастабильных и полиморфных форм, чувствительных к условиям дренажа. Кальцит является наиболее распространенной и относительно подвижной формой карбоната кальция. Это соединение весьма дисперсное и сильно влияет на pH почв, а следовательно, и на поведение микроэлементов. Кроме того, карбонаты снижают подвижность микроэлементов вследствие сорбции собственными высокодисперсными фракциями, а также оксидами железа и марганца, оседающими на поверхности карбонатов. Слабая подвижность микроэлементов в карбонатных почвах негативно сказывается ка минеральном питании растений. Концентрация в растениях (Agrestis capillaris) большинства из исследованных 55 химических элементов уменьшалась с увеличением значений pH от 5,2 до 7,8, вызванным привнесением в почву карбоната кальция. Заметное уменьшение концентрации отмечено для различных элементов (Ag, As, В, Ba, Eu, Ge, Li, Mn, Ni, P и Sr). Увеличение концентрации обнаруживалось только в отношении кальция, ртути, магния, молибдена и серы.
Внесение мела, особенно в сочетании с навозом, приводило к существенному снижению подвижности цинка в черноземе. Адсорбция цинка чистым карбонатом кальция (СаСО3) происходила до концентрации около 0,5 мкмоль/г. Выше этого предела адсорбция цинка сопровождалась образованием осадка смитсонита — ZnCO3.
Уменьшение содержания мобильных микроэлементов в почве по критического уровня сопровождается появлением признаков их дефицита у растений. Наиболее типичное и опасное заболевание культурных растений, выращиваемых на автоморфных нейтральных и щелочных почвах, — карбонатный хлороз.
Однако низкая активность катионов кальция в растворах кислых почв отрицательно сказывается на интегральной целостности мембран, интенсивности многих метаболических процессов, что приводит к появлению симптомов кальциевой недостаточности у растений, а также к избыточному накоплению в них микроэлементов. Поэтому известковые материалы входят как обязательный элемент в систему удобрений кислых почв. Негативная сторона этого агрономического приема состоит в уменьшении подвижности микроэлементов в почве и их доступности растениям.
Фосфаты. В почвах в основном представлены метастабильными и метаморфными разновидностями. Некоторые формы фосфатов металлов характеризуются слабой растворимостью в воде. Поэтому повышенное содержание фосфатов в почве и интенсивное применение фосфорных удобрений, особенно при нейтральной и щелочной реакции среды, способствуют закреплению металлов почвенно-поглощающим комплексом. В дерново-подзолистых почвах с повышенным содержанием фосфатов возможна иммобилизация микроэлементов (Cu, Zn) и проявление симптомов их недостатка у растений.
Сульфиды, сульфаты, хлориды. В почвах, формирующихся в условиях влажного климата, большого влияния на подвижность микроэлементов не оказывают, но играют в этом процессе важную роль в почвах аридных климатических зон. Микроэлементы могут осаждаться в виде сульфидов, которые в аэрируемых условиях превращаются в более растворимые сульфаты. Хлориды и сульфаты металлов хорошо растворимы и поэтому легкодоступны растениям.
Органическое вещество. Состоит из разнообразных органических соединений и продуктов их взаимодействия с минеральными компонентами почв. Условно органические соединения почвы подразделяют на две большие группы — органические остатки и гуминовые вещества. Органические остатки служат источником формирования гумуса и представляют собой отмершие части живых организмов, которые еще не утратили своего анатомического строения. В форме органических остатков временно резервируются многие микроэлементы. Скорость высвобождения микроэлементов из растительных остатков зависит от интенсивности их разложения и гумификации. Темпы минерализации фитомассы тесно связаны с химическим составом растительных остатков. Например, листья клевера (соответственно и высвобождение из них микроэлементов) минерализуются значительно быстрее, чем хвоя голосеменных растений.
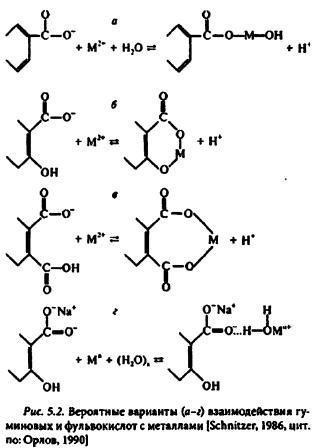
В почве подвижность микроэлементов зависит от их взаимодействия с гуминовыми веществами (рис. 5.2). Реакционная способность гуминовых веществ определяется разнообразными функциональными группами в их составе. К наиболее важным из них относятся карбоксильные, спиртовые, фенольные, метоксильные, амидные группы. Кроме того, отмечены эфирные и кетонные группы. Количество реакционных центров увеличиваем но мере повышения степени гумификации органического вещества. Взаимодействие гуминовых веществ почвы с ионами металлов идентифицируют как ионообменные реакции, адсорбция на поверхности. комплексообразование, реакции коагуляции. В результате таких взаимодействий образуются простые соли (гуматы, фульваты) и комплексные соединения. Устойчивость комплексов гуминовых кислот с металлами уменьшается в следующей последовательности:
Pb2+ > Cu2+ > Ni2+ > Co2+ > Zn2+ > Cd2+ > Fe2+ > Mn2+ > Mg2+.
Однако при значениях pH 5,0 существенных различий в показателях устойчивости между комплексами таких металлов, как кальций, магний, кобальт, никель, цинк, не выявлено.
Преобладающая часть микроэлементов, связанных органическим веществом почвы, аккумулируется в фульвокислотах. По сравнению с фракцией гуминовых кислот фульвокислоты обладают большей дисперсностью, гидрофильностью, в большей степени обогащены функциональными группами. Взаимодействие металлов с гуминовыми веществами сопровождается появлением растворимых или малорастворимых в воде соединений. Растворимость органоминеральных комплексов зависит от химической природы и соотношения их компонентов, а также от реакции среды. Гуминовые кислоты характеризуются большей, чем фульвокислоты, склонностью к образованию нерастворимых в воде соединений с металлами. Однако этот вывод в большей степени относится к катионам двухвалентных металлов, а также к катионам железа и алюминия.
Гуматы щелочных металлов считаются хорошо растворимыми. При взаимодействии растворов гумусовых кислот со щелочами образуются истинные растворы гуматов после начальной стадии пептизации. Фульвокислоты также образуют нерастворимые соединения с микроэлементами, но только при очень низких значениях отношения органического вещества к микроэлементу, которые крайне редко встречаются в почвах.
Гуминовые вещества могут чисто химическим путем восстанавливать металлы с переменной валентностью, увеличивая таким образом их мобильность. Наибольшая скорость восстановления железа гуминовыми кислотами отмечена при pH NPK + известь - навоз - известь - NPK - неудобренная почва, где NPK — минеральные удобрения, содержащие азот, фосфор и калий. Наиболее сильно плотность отрицательного заряда увеличивается в интервале pH 3-8.
Адсорбционные свойства почвенно-поглощающего комплекса. Химическая неоднородность компонентов ППК влияет на состав и свойства функциональных групп на поверхности частиц почвы (табл. 5.2), а следовательно, и на степень их участия в ионообменных и адсорбционных процессах. В основе одного из механизмов образования зарядов на поверхности почвенных частиц лежит диссоциация функциональных групп ППК, определяющая ионообменные процессы в почве. Наибольшую концентрацию на поверхности почвенных частиц имеют следующие функциональные группы: -SiOOH, -СООН, =COH, =AlOH, =FeOH. Две первые группы более активны в кислой среде, а три последние в нейтральной и щелочной. Вероятно, участие других функциональных групп 8 катионообменных процессах значительно меньше, что обусловлено более низким содержанием этих групп в почве, а также их химическими свойствами.
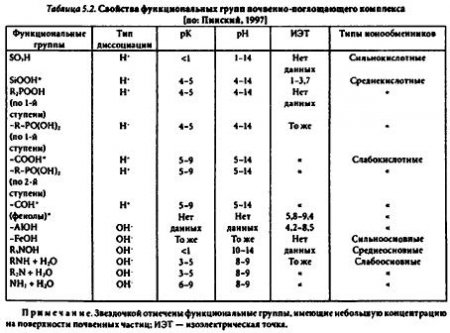
Многие из этих функциональных групп в нормальных условиях заряжены положительно и проявляют свойства анионитов. В тоже время они могут образовывать координационные соединения с некоторыми металлами, особенно с переходными металлами-микроэлементами, и обеспечивать их избирательное поглощение из растворов ППК.
Сродство адсорбентов, обладающих свойствами сильных кислот, к катионам прямо пропорционально величине их заряда. Взаимодействие таких адсорбентов с катионами осуществляется за счет сил электростатической природы. В ряду одинаково заряженных ионов избирательность возрастает с увеличением радиуса негидратированных ионов, что обусловлено увеличением поляризуемости их электронных оболочек и уменьшением степени гидратации. С уменьшением радиуса гидратированных ионов уменьшаются энергетические затраты на трансформацию гидратных оболочек при адсорбции. Для таких адсорбентов можно привести следующие лиотропные ряды:
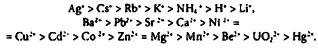
Среднекислые адсорбенты обладают высоким сродством к протону, поэтому их сорбционные свойства зависят от pH среды. Взаимодействие функциональных групп такого рода адсорбентов с катионами происходит как за счет электростатических сил, так и за счет образования координационных связей. По этой причине селективность сорбции катионов соединениями со среднекислыми функциональными группами зависит не только от заряда иона, но и от строения его внешних электронных оболочек. В обобщенном виде лиотропные ряды ионов для среднекислых адсорбентов в кислой среде могут быть представлены следующим образом:
Адсорбенты со слабокислыми свойствами отличаются повышенным сродством к протонам, ионам тяжелых металлов и щелочноземельных элементов:
В связи с тем что компоненты ППК характеризуются различным набором кислотно-основных свойств, лиотропные ряды ионов зачастую сильно отличаются от приведенных и зависят от свойств конкретной почвы.
Сорбция ионов ППК определяется не только свойствами его компонентов, но и свойствами катионов. Например, при низких концентрациях микроэлементов наибольшее количество Zn2+ неспецифически связывается оксидами железа и марганца. При тех же условиях наибольшее количество катионов Cu2+ специфически связывается органическим веществом почвы.
Ионообменные реакции и адсорбционные процессы в почве (в том числе с участием функциональных групп) тесно связаны с реакцией среды и окислительно-восстановительным потенциалом. От значений того и другого показателя зависит подвижность в почве большинства микроэлементов. С увеличением pH и Eh происходит селективное поглощение почвой катионов с меньшей плотностью заряда. Наиболее сильная зависимость подвижности соединений микроэлементов от реакции среды и окислительно-восстановительного потенциала отмечена для железа и марганца. Специфика сорбционных процессов для отдельных микроэлементов, обусловленная влиянием окислительно-восстановительных условий среды, подробнее рассмотрена дальше. Влияние pH на адсорбцию ионов опосредовано регуляцией активности функциональных групп ППК и механизмов ионного обмена в почвах.
Колебания емкости катионного обмена (EKO) отдельных компонентов ППК довольно значительны (табл. 5.3), что объясняется природной вариабельностью свойств компонента и спецификой методов при определении значений ЕКО.
Вклад каждого компонента в формирование общей EKO почвы зависит как от содержания данного компонента в почве, так и от его ЕКО. Вместе с тем общую емкость катионного обмена почвы нельзя получить, просуммировав вклады отдельных компонентов ППК. Значения этого показателя сильно изменяются в результате взаимодействия компонентов между собой.
В обобщенном виде механизмы катионного обмена в почвах могут быть представлены в виде следующей схемы (рис. 5.4). К закреплению ионов тяжелых металлов компонентами твердой фазы почвы приводят следующие основные типы взаимодействий: неспецифический и специфический ионные обмены, необменное поглощение, образование трудно растворимых соединений (Ладонин, Пляскина, 2004). Неспецифический ионный обмен приводит к поглощению ионов тяжелых металлов ППК и эквивалентному вытеснению в раствор катионов щелочных и щелочноземельных элементов (Na+, К+, Ca2+, Mg2+):
ППК-Са + М2+ ↔ ППК-М + Ca2+.
В результате специфического обмена ионы тяжелых металлов вытесняют в раствор более прочно связываемые почвой ионы: Н+, FeJ+, Mn2+, Al3-. Необменное поглощение тяжелых металлов происходит без выделения в раствор других элементов вследствие образования поверхностных комплексов с различными функциональными группами органических соединений и ОН-группами почвенных минералов. Необходимым условием образования трудно растворимых соединений тяжелых металлов является уровень содержания соответствующих анионов и катионов, достаточный для образования малорастворимого соединения. Твердая фаза почвы лишь косвенно влияет на такие реакции.
Закрепление некоторых микроэлементов (Сu2+ Zn2+) различается в тех или иных горизонтах почвы. Доля специфического обменного поглощения этих микроэлементов в дерново-подзолистой почве максимальна при их низких концентрациях в растворе.
Взаимодействие с ППК анионов, в частности анионов микроэлементов, изучено заметно меньше, чем катионов. В значительной степени это обусловлено тем, что анионообменная емкость почв существенно ниже, чем катионообменная емкость. Считается, что селективность положительно заряженных центров ППК к анионам выше, чем отрицательно заряженных к катионам. Причина этого состоит в специфике природы положительно заряженных центров и их меньшей гидратированности. С ростом pH отмечена устойчивая тенденция к уменьшению сорбции почвой анионов молибденовой кислоты, а также арсената, три полифосфата, пиро- и ортофосфата.
Соединения тяжелых металлов (включая микроэлементы) в почве отражены на рис. 5.5.
Микроорганизмы почвы. Практически во всех элементарных почвенно-биологических процессах, прямо или косвенно влияющих на подвижность микроэлементов и их доступность растениям, участвуют микроорганизмы. В качестве важнейших процессов Т.В. Аристовская выделяет разложение растительного опада, образование гумусовых веществ, разложение гумуса, деструкцию минералов почвообразующей породы и новообразование минералов. Главная роль в пополнении запасов микроэлементов в почве и изменении ее физико-химических свойств принадлежит биохимической деструкции минералов. Выделяют два основных вида воздействия микроорганизмов ка породу: ферментативное разрушение и деструкцию слизями микроорганизмов. Прямому воздействию микробных ферментов подвержены минералы, содержащие в своем составе элементы с переменной валентностью. Освобождающаяся в ходе окислительно-восстановительных реакций энергия используется микроорганизмами для обеспечения метаболических процессов. Примером ферментативного разложения минералов служит деструкция пирита, халькопирита и других сульфидов представителями рода
Thiobacillus, способными окислять серу и двухвалентное железо. Эти окислительно-восстановительные реакции происходят при непосредственном контакте микробных клеток с поверхностью минералов.
Ферментативным путем могут разрушаться минералы, имеющие в своем составе соединения не только Fe(II), но и Fe(III). Многие гетеротрофные микроорганизмы в анаэробных условиях используют в процессе дыхания в качестве акцептора электронов Fe(III) вместо кислорода. Восстановление окисленных форм железа под влиянием редуктаз микроорганизмов способствует повышению мобильности этого элемента в почве. У микроорганизмов известны по крайней мере две редуктазные системы, участвующие в восстановлении Fe(III): ферриредуктазная и нитратредуктазная. В первой системе в качестве акцепторов электронов используется только Fe3-, она обнаружена у облигатных анаэробов. В нитратредуктазной системе акцепторами электронов могут быть NO3- и Fe3+, эта система характерна главным образом для факультативно анаэробных бактерий. В присутствии нитратов восстановление железа подавляется, так как микроорганизмы переключаются на нитратное дыхание — более энергетически выгодный процесс, чем восстановление Fe(III). При достаточном количестве легко разлагаемого органического вещества бактериальное восстановление аморфных и кристаллических форм оксидов Fe(III) может способствовать увеличению в почве количества доступных для растений форм железа.
Микроорганизмы могут принимать участие в восстановлении не только оксида железа, но и диоксида марганца. Восстановление бактериями окисленных форм марганца ускоряется при добавлении в среду глюкозы и лимонной кислоты. Вероятно,этот процесс может происходить как в анаэробных, так и в аэробных условиях, если а среде находятся адекватные доноры электронов. В восстановлении окисленных форм марганца принимают участие разнообразные гетеротрофные микроорганизмы. Наиболее ярко Мn-редуцирующая способность выражена у
Bacillus circulans и
Clostridium polymyxa. Практически все бактерии, восстанавливающие железо, способны восстанавливать марганец, однако обратная закономерность прослеживается далеко не всегда. В ризосфере растений (пшеница) количество редуцирующих марганец организмов варьирует в зависимости от генотипических особенностей растений. Восстановление окисленных форм марганца не является достаточным условием повышения подвижности этого элемента в почве. При определенных значениях pH возможно образование нерастворимых карбонатов и гидроксидов Mn(II).
Иммобилизацию марганца в почвах определяет окисление его двухвалентной формы. Эта реакция осуществляется под воздействием кислорода, образующегося в результате разложения пероксида водорода каталазой или пероксидазой, и сопровождается накоплением окисленных форм марганца ка поверхности клеток микроорганизмов. Окисленные формы марганца накапливаются вследствие не только ферментативного, но и небиологического окисления. Образуемые с помощью микроорганизмов оксиды марганца могут катализировать химическое окисление элемента. В окислении восстановленных форм марганца принимают участие бактерии, мицеллиальные грибы и дрожжи. Процесс может осуществляться одновременно двумя организмами, например ассоциацией грибов с микоплазмой
Metallogenium. Постепенная кристаллизация накопленных на поверхности микробных клеток нерастворимых форм металлов — широко распространенный механизм биогенного образования минералов в почвах. Так образуется кальцит при минерализации обогащенных кальцием органических остатков, а также формируются минералы оксидов железа и марганца.
Необходимо отметить, что ферментативная деструкция минералов может происходить при непосредственном или опосредованном (через микробные выделения) воздействии микроорганизмов на минералы. В целом, однако, ферментативная деструкция минералов специфична, поскольку оксидазная или редуктазная активность микроорганизмов проявляется при наличии в минералах элементов с переменной валентностью.
Менее специфична деструкция почвообразующих пород, опосредованная продуктами жизнедеятельности микроорганизмов, в частности слизями. Способностью к слизеобразованию обладают многие почвенные бактерии и водоросли. По химическому составу слизи представляют собой «основном полисахариды, содержащие урановые кислоты. Функциональные группы этих полимеров (фенольные, гидроксильные) участвуют в образовании комплексных соединений с микроэлементами и таким образом способствуют их переводу в более доступную для растений форму.
Важная роль в мобилизации микроэлементов из минералов принадлежит микроорганизмам, продуцирующим сильные химические реагенты — минеральные и органические кислоты, щелочи, различные хелаторы и редуктанты. На ранних стадиях почвообразования мобилизацию питательных веществ из минералов определяют микроорганизмы, выделяющие сильные минеральные кислоты. Так, образуемая культурой
Thiobacillus Shimxidаns серная кислота способствует интенсивному разрушению алюмосиликатов. В биогеоценозах с интенсивным круговоротом углерода решающее значение в выветривании имеют органические, а не .минеральные кислоты микроорганизмов. В микробных выделениях идентифицированы разнообразные органические кислоты: муравьиная, уксусная масляная, молочная, щавелевая, лимонная, янтарная, винная и др. Органические кислоты выделяют не только бактерии, но и микроскопические грибы, причем наиболее активными продуцентами выступают представители родов
Penicillium и
Aspergillus. Интенсивность разрушения минералов органическими кислотами не всегда соответствует степени их диссоциации, так как действие органических кислот связано не только с их кислотными свойствами, но и с комплексообразующими. Последние способствуют поступлению в почвенный раствор разнообразных по составу хелатов микроэлементов. Разрушающее действие на минералы относительно высокомолекулярных органических кислот, как правило, меньше, чем низкомолекулярных. Сильная деструкция алюмосиликатов происходит под влиянием лимонной кислоты.
Источниками биогенных щелочей в почвах могут быть соли слабых органических кислот и сильных оснований, образующиеся при разложении растительных остатков: карбонаты и бикарбонаты. Образование щелочей происходит также в процессе аммонификации веществ белковой природы. С накоплением в среде щелочных продуктов азотного обмена некоторых бактерий связывают разложение труднорастворимых фосфатов. Под влиянием продуктов аммонификации уробактерий происходит деструкция даже прочных минералов: плагиоклаза и кварца.
Важная роль в мобилизации микроэлементов (особенно железа) принадлежит соединениям, названным сидерофорами. Сидерофоры выделяют многие микроорганизмы, особенно грибы, в ответ на недостаток железа в среде. Сидерофоры представляют собой производные никотианаминов, способные формировать стабильные водорастворимые комплексы с металлами, в частности с Fe(III). У сидерофоров бактериального происхождения (пиовердин) выше сродство к железу, чем у фитосидерофоров. Бактериальные сидерофоры способны извлекать его из фитосидерофорных комплексов. Комплексы железа с сидерофорами грибов
(Rhizopus arrhizus) и фитосидерофорами сопоставимы по устойчивости к диссоциации, поэтому первые могут быть вполне доступным для растений источником железа.
В стерильных карбонатных почвах растения (кукуруза, подсолнечник) проявляли типичные симптомы Fe-дефицита, тогда как в нестерильных условиях этот эффект не наблюдался. Пиовердин как один из основных представителей сидерофоров, продуцируемых флуоресцирующими бактериями
Pseudomonas, положительно влиял на поступление железа в растения. Аналогичные результаты получены в отношении других сидерофоров микробного происхождения: ферриоксамина, родоторуловой кислоты.
Концентрация сидерофоров в почвенном растворе варьирует в зависимости от типа почвы в интервале 10-300 нмоль/л, наибольшее выделение сидерофоров отмечено в ризосфере. Выявлена способность сидерофоров угнетать развитие фитопатогенных микроорганизмов в ризосфере. Механизм такого угнетения объясняют появлением в почве Fe-дефицита. обусловленного связыванием Fe2+ в прочный комплекс. Этот комплекс могут усваивать продуценты сидерофоров, а микроорганизмы-патогены не могут. Высшие растения, как правило, не страдают от недостатка железа, вызванного продуцированием сидерофоров, и могут расти при гораздо более низких (- в 1000 раз) концентрациях железа, чем микроорганизмы.
Однако переоценивать роль Fe-сидерофоров в минеральном питании высших растений не следует. Концентрация сидерофоров в почве слишком мала, чтобы существенно влиять на питание растений. Сидерофоры разрушаются в ризосфере бактериями, а сидерофорные комплексы достаточно сильно адсорбируют частицы почвы. Наконец, микроорганизмы могут продуцировать сидерофоры, характеризующиеся высоким сродством к железу, что ограничивает возможности растений поглощать этот микроэлемент.
Степень воздействия микроорганизмов на подвижность микроэлементов различна, что определяется почвенными условиями и составом биоты. Доступность микроэлементов растениям снижается при усилении аккумулятивных и окислительных процессов в результате деятельности микроорганизмов. Напротив, подвижность микроэлементов существенно возрастает при функционировании микроорганизмов, редуцирующих окисленные соединения металлов, а также выделяющих хелатирующие агенты.
Беспозвоночные животные. Почва — среда обитания многих беспозвоночных животных: дождевых червей, коллембол, мокриц и др. Они играют важную роль в трансформации органического вещества и соединений питательных элементов в наземных экосистемах. Например, поток почвенного азота (N) через популяцию дождевых червей в непахотных экосистемах достигает 63 кг/га в год. Вследствие высокой скорости поглощения пищи и локомоторной активности черви модифицируют среду обитания, состав и численность популяций микроорганизмов, вызывая тем самым изменения в направленности и кинетике разнообразных процессов.
Влияние дождевых червей на популяции почвенных микроорганизмов (численность, разнообразие, активность) неоднозначно. В процессе переваривания пищи животные могут уменьшать микробную биомассу: убивают значительно больше микроорганизмов, чем ассимилируют. Процесс переваривания микроорганизмов начинается с деструкции их клеточных мембран «киллерными» веществами пищеварительного отдела кишечника животных. После нарушения целостности микробной клетки ее содержимое становится доступным как для автолитических ферментов микроорганизмов, так и для ферментов животных. В мертвой микробной биомассе, подвергшейся в кишечнике или экскрементах животных автолизу и лизису, мобилизация питательных элементов возрастает.
В пищеварительном тракте дождевых червей возможно уменьшение соотношения между биомассами грибов и бактерий. При этом в сотни раз возрастает численность бактерий-аммонификаторов, вероятно, за счет реутилизации бактериями грибной массы. Бактериальная масса обогащена азоток в большей степени, чем масса грибная. Высокое содержание азота стимулирует минерализацию в органических субстратах. Поэтому в экскретах дождевых червей минерализация обычно усиливается. Вызванное животными перераспределение доминирования в микробном сообществе носит долговременный характер.
В то же время встречаются сведения об отсутствии каких-либо изменений в величине микробной биомассы. Этот факт объясняют селективным поведением дождевых червей, т. е. поглощением ими фрагментов почвы, обогащенных микроорганизмами. Кроме того, не все микроорганизмы погибают в кишечнике. Селекция микроорганизмов происходит вследствие выборочного «киллерного» воздействия пищеварительных секретов дождевых червей на микробные клетки. Эти секреты не убивают клетки толерантных микроорганизмов.
Некоторые быстро растущие бактерии интенсивно размножаются в заднем отделе кишечника, что приводит к увеличению их численности и биомассы. Экскреты (мукус) в полости кишечника стимулируют этот процесс. Мукус представляет собой органическую смесь гликопротеинов, глюкозидов и небольших белковых молекул. Он служит пищей для гетеротрофных микроорганизмов и быстро включается в состав микробной биомассы кишечника. В целом мукус в полости кишечника обеспечивает лучшие условия для развития микроорганизмов, чем органическое вещество не обработанной червями почвы. Экскреты дождевых червей обогащены необходимым для микроорганизмов аммонийным азотом, способным стимулировать минерализацию в почве, вызывая долговременные кумулятивные эффекты.
Эффекты, индуцируемые взаимодействием между беспозвоночными животными и микроорганизмами, определяют разнообразие модифицирующего действия дождевых червей ка подвижность микроэлементов в почве. Описано как увеличение, так и уменьшение мобильности микроэлементов в почве под влиянием дождевых червей. Черви
Еisenia jetida стимулировали увеличение в почве концентрации растворимых в воде фракций меди и цинка, тогда как
Aporrectodea tuberculala не влияли на эти показатели. Черви
Lumbricus terrestris повышали концентрацию в почве извлекаемых ЭДТА форм меди и марганца, но не влияли на содержание аналогичных форм железа и цинка, как и на концентрацию форм железа и цинка, извлекаемых ДТПA. Увеличение в почве концентрации цинка (экстракция ДТПА или NH2OH-HCl-смесью) вызывали дождевые черви
Pheretima sp. В копролитах
Aporrectodea caliginosa зарегистрировано повышенное содержание молибдена, а у растений в присутствии копролитов — активирование Mo-зависимых реакций: нитратредуктазной способности и N2-фиксации. Известны также случаи отрицательного действия вермикомпостирования на мобильность меди и цинка в компосте.
По нашим данным (табл. 5.4), дождевые черви
(Е. fetida, A. caliginosa, L. terrestris) могут стимулировать (в 5-10 раз) образование в копролитах (односуточных) растворимых в воде форм железа и марганца в случае трансформации почвы с изначально низкой стартовой мобильностью этих микроэлементов. В девятисуточных копролитаx эффект индуцированного червями повышения растворимости микроэлементов, как правило, усиливался. Снижению мобильности микроэлементов в почве (в 5-10 раз) способствовали ее сушка и привнесение карбоната кальция. Трансформация в кишечнике червей почвы с исходно высокой концентрацией микроэлементов, напротив, либо не влияла ка концентрацию в копролитах извлекаемых водой микроэлементов (Fe), либо уменьшала значения этого показателя (Fe, Mn), возможно, вследствие их частичной иммобилизации. По-видимому, приведенные противоречивые сведения о влиянии червей на полвижность микроэлементов во многом объясняются разнообразием стартовых значений этого показателя в субстратах.
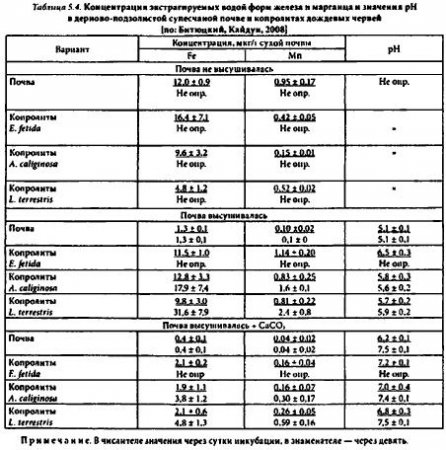
Повышение мобильности химических элементов в копролитах по сравнению с исходной почвой связывают с активностью ассоциированных с червями микроорганизмов, в частности, с индуцируемой ими деградацией органических соединений в кишечнике червей. Однако такой путь вероятен при относительно длительных периодах вермикомпостирования (10-50 сут). Мы регистрировали повышение подвижности микроэлементов в копролитах (экстракция дистиллированной водой) практически сразу (через сутки) после их выделения, происходившего при относительно низкой температуре +6°С и сопровождавшегося подщелачиванием копролитов (табл. 5.4).
В таких условиях мобилизация микроэлементов возможна благодаря образованию их растворимых комплексов с органическими лигандами, выделяемыми стенками кишечника червей или кишечными микроорганизмами. Повышению мобильности железа может также способствовать Fe3+-редуктазная активность экскретов. Образуемые в ходе этой реакции формы Fe2+ растворимы в воде при более высоких значениях pH, чем формы Fe3+, и биологически более активны.
Экскреты дождевых червей (поверхностные + кишечные), изменяющие подвижность микроэлементов я почве, могут быть их непосредственным источником (табл. 5.5).
Наибольшая концентрация микроэлементов обнаружена у наиболее массивных червей:
L. terrestris, L. rubellus и A. caliginosa, а наименьшая — у самого мелкого червя
Е. fetida. Значимых различий между массивными видами червей по концентрациям большинства микроэлементов не выявлено, однако, экскреты
L. terrestris характеризовались наибольшей концентрацией цинка. Более 80% от общего железа приурочено к коллоидной фракции экскретов (слизи) червей
(A. caliginosa, Е. fetida). В целом аналогичная закономерность (60-80%) отмечена и в отношении марганца.
Железо — доминирующий микроэлемент в составе экскретов червей (табл. 5.5). He случайно вызываемое экскретами червей
(L. rubellus и A. caliginosa) увеличение концентрации хлорофилла в листьях огурца (выращивали без Fe, Mn и Zn), происходило только вследствие поступления в побег железа (табл. 5.6) в отличие от других микроэлементов (Mn, Zn). Следовательно, экскреты червей могут служить источником железа для растений.
Физиологическое действие на растения (концентрацию хлорофилла в листьях, содержание Fe в побегах) зоогенных форм железа в основном зависело от его концентрации в питательном растворе. При уровнях железа не менее 0,7 мкмоль/л физиологическое действие экскретов червей идентично традиционным Ре-источникам: Fe2(SO4)3 и Fe-цитрату. При более низких концентрациях железа (0,06 мкмоль/л) экскреты существенно уступали по своему действию хелату железа — Fe-цитрату. Очевидно, какая-то часть содержащегося в экскретах железа мало доступна растениям. Однако суточной дозы экскретов, полученной от трех особей
A. caliginosa, было достаточно, чтобы снабжать растения огурца железом в течение 41 сут. Подобного эффекта не наблюдалось в опытах с экскретами маленького червя
Е. fetida, характеризовавшимися самыми низкими концентрациями железа, даже при еженедельной смене растворов. Очевидно, наибольший биологический эффект от экскретов как источников железа можно ожидать при относительно высокой плотности дождевых червей в почве и их локомоторной активности.
Несмотря на положительное влияние червей на подвижность микроэлементов в обогащенной CaCO3 почве, привнесение в нее экскретов червей (в суточной дозе) не вызвало ожидаемых улучшений в питании огурца. Аналогичный результат получен нами в почвенной культуре с другими видами растений: подсолнечником, горчицей.
Фактическая эффективность минерального питания растений во многом зависит от их генотипически обусловленной способности усваивать труднодоступные формы питательных элементов, He случайно использование химических экстракций для оценки «биодоступности» элементов до сих пор остается под вопросом. Надежнее оценка доступности питательных элементов с помощью анализа ксилемного сока (пасоки) растений.
Из результатов анализа следует, что внесение в почву карбоната кальция вызывало наибольшие нарушения в транспорте из корней в побег огурца цинка и марганца (соответственно в 5 и 2,2 раза по сравнению с контролем), но не железа (табл. 5.7).
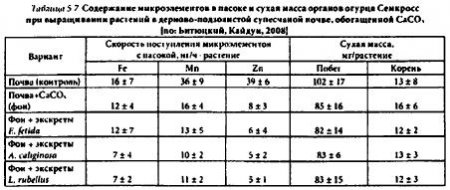
Двудольные растения могут специфически адаптироваться к дефициту железа, продуцируя корнями H- или увеличивая в корнях активность Fe3+-редуктазы. Объекты наших исследований — различные сорта огурца также вызывали снижение в питательных растворах значений pH (Δ pH 2,1 ± 0,8) в ответ на Fe-дефицит. Четких ответных реакций растений (разных видов) на недостаток других микроэлементов до сих пор не описано. Видимо, поэтому опытные растения огурца могли относительно успешно преодолевать ограниченную (карбонатом кальция) мобильность только железа. Экскреты червей, в частности, привнесенные в небольшой дозе, не содержали достаточного количества цинка и марганца, находившихся в фактическом дефиците (табл. 5.5). Поэтому не удивительно, что в почвенной культуре не наблюдалось положительных эффектов после внесения экскретов червей.
Таким образом, зоогенные эффекты зависят не только от специфики почвы, но и от физиологических особенностей поглощения микроэлементов, присущих растениям.
Карбонатные почвы наименее благоприятны для возделывания культурных растений. Они характеризуются высоким содержанием карбонатов и щелочной реакцией среды, что вызывает снижение мобильности большинства микроэлементов (кроме Mo) и появление у растений типичных признаков карбонатного хлороза. Кроме того, они характеризуются низким содержанием органического вещества, доступного азота и фосфора. Карбонатные почвы, занимающие около 800 млн. га, наиболее типичны для засушливых регионов. Низкой обеспеченностью питательными элементами (включая микроэлементы) характеризуются песчаные почвы, занимающие около 900 млн. га. Они распространены главным образом в засушливых регионах. В Западной Сибири наиболее низкой обеспеченностью подвижными микроэлементами отличаются почвы каштановые и черноземы южные, дерново-подзолистые легкого гранулометрического состава и торфяные. Перечисленные почвы — основа земельного фонда Западной Сибири.
В целом дефицит микроэлементов — глобальное явление, широко распространенное у культурных растений на различных континентах нашей планеты.