Транспорт микроэлементов по ксилеме
Ксилема состоит из проводящих клеток, лишенных живого содержимого. У покрытосеменных растений ксилема представлена в основном сосудами — полыми трубками из клеточных стенок. У голосеменных растений функцию проведения выполняют остроконечные клетки — трахеиды. Сосуды ксилемы сообщаются между собой через поры — углубления во вторичных клеточных стенках. Корневое давление и градиент водного потенциала между корнями и листьями — основные движущие силы ксилемного транспорта питательных веществ, включая микроэлементы.
Загрузка сосудов ксилемы микроэлементами осуществляется с помощью передаточных клеток и представляет собой процесс, контролирующий поступление питательных элементов в побег. Молекулярные механизмы загрузки ксилемы микроэлементами пока слабо изучены.
В момент загрузки ксилемы двух валентное железо восстанавливается до трехвалентных форм, что может произойти после его высвобождения из комплекса с никотианамином. Это замещение и образование комплексов типа (Fe-цитрат-ОН)-1 или (Fe-цитрат2)-3 достаточно легко происходит в диапазоне pH 5,5-6,0.
К сосудам ксилемы медь перемещается по симпласту либо в форме комплексов с ни-котианамином, либо в форме катиона. Соответственно проникновение меди в сосуды ксилемы может происходить с участием никотианамина или АТФаэ P-типа. Возможно, в транспорте меди задействованы также белки неидентифицированной природы. В растениях
Arabidopsis описано более 30 генов, кодирующих синтез белков-переносчиков с доменами типа Atx, способных связывать различные металлы.
Транспорт микроэлементов по ксилеме может осуществляться как я ионной, так и в хелатированной форме. В целом мобильность и форма, в которой микроэлементы транспортируются по ксилеме, во многом зависят от значений pH и Eh ксилемного сока. Реакция среды сока ксилемы находится в диапазоне pH 5,5-6,5, она определяется буферными свойствами компонентов ксилемного сока (органических кислот и др.), а также активностью Н+-транспортных систем, расположенных в мембранах клеток ксилемной паренхимы. Пока мало сведений о величине Eh сока ксилемы. У сахарного клена
(Acer saccharium) значения этого потенциала находятся в диапазоне от 220 до 250 мВ.
Железо по ксилеме транспортируется главным образом в виде Fe3+-цитратного комплекса (рис. 3.5). У мутанта
Arabidopsis frd3(manl) с низкой по сравнению с диким видом концентрацией цитрата в экссудате ксилемы железо аккумулировалось преимущественно в корнях, а не в побеге. Гены FRD3 кодируют трансмембранный белок, образующийся в перицикле и сосудах корней и имеющий отношение к поступлению цитратов в ксилему. Следует отметить, что у мутантов недостаток железа в ксилемном экссудате сопровождался накоплением железа в апопласте побега. Возможно, нарушения в ксилемном транспорте железа могут компенсироваться его транспортом в побег по апопласту или по флоэме, куда железо может поступать из ксилемы.
В транспорте железа по ксилеме участвует не только лимонная кислота, но и никотианамин. В трансгенных растениях табака, у которых синтез никотианамина был подавлен, в листьях и цветках отмечались пониженные концентрации железа, а также меди и цинка.
В ксилемном соке риса (стратегия II) встречались также комплексы железа с мугеневой кислотой. Однако а такой форме транспортировалось не более 12% железа. Видимо, у риса кроме фитосидерофоров в транспорте железа могут быть задействованы лимонная кислота или другие лиганды, так как концентрация свободных ионов железа в ксилемном соке была экстремально низкой. Отмечена способность фитосидерофоров образовывать комплексы и с ионами других микроэлементов: Zn2+, Ni2+, Mn2+.
Никотианамин — основной лиганд, участвующий в транспортировке по ксилеме цинка и меди. У томата chloronerva с нарушенным синтезом никотианамина наблюдали снижение накопления меди в листьях на 80% по сравнению с диким видом. Аналогичные результаты получены с мутантами табака.
В растениях-гипераккумуляторах значительная часть цинка, никеля, а также кадмия связана в комплексы с органическими кислотами и аминокислотами. В ксилемном соке сои никель ассоциирован преимущественно с органическими кислотами и аминокислотами. Распространены также комплексы никеля с чал атом, однако цитратные комплексы превалируют над малатными так как первые стабильнее. Увеличение концентрации никеля в среде сопровождалось адекватным увеличением концентрации гистидина в ксилемном экссудате у растений-гипераккумуляторов никеля
Alyssum lesbiacum. Такое возрастание накопления гистидина сопровождалось усилением экспрессии генов ATP-PkT1, кодирующих синтез ферментов первой стадии биосинтеза этой аминокислоты. В ксилемном экссудате на ранних этапах развития
Glycinc max превалировали комплексы никеля с аминокислотами или пептидами, а на более поздних — с органическими кислотами, содержание последних с возрастом увеличивалось. Помимо комплексов никеля с органическими лигандами в ксилеме идентифицированы аквакомплексы Ni(H2O)6в2+.
Преимущественно в несвязанных формах транспортируются хлор (Cl-), молибден (MoO4в2-) и бор (H3BO3). Ксилемный транспорт хлора зависит от скорости роста побега и транспирации. В листьях галофита
Atriplex spongiosa уровень концентрации Cl+ составлял при влажности воздуха 95-100% 8 ммоль/л, а при влажности 40-45% - 93 ммол/л. В целом концентрация ионов хлора и ксилеме возрастает с увеличением внешней концентрации этого аниона, однако, амплитуда прироста концентрации хлора в ксилеме во многом определяется внешними условиями. При аммонийном питании концентрация хлора в ксилеме возрастала сильнее, чем при нитратном питании растений. Транспорт аммония в побег осуществляется в форме органических соединений. Следовательно, увеличение в этом случае концентрации в ксилеме ионов хлора необходимо для поддержания ионного баланса и предотвращения изменений значений pH, сопровождающих процесс N-ассимиляции.
Механизмы разгрузки ксилемы в побеге также пока мало понятны. Железо из сосудов ксилемы может высвобождаться в форме комплексов с никотианамином или цитратом, а также в форме двухвалентных хатионов железа. У мутанта томатов
chloronerva (нарушен синтез никотианамина) основное количество железа откладывалось вдоль жилок и не транспортировалось в листовые пластинки, что вызывало пожелтение последних.
С помощью 34Fe у ячменя в базальной части листьев обнаружена зона меристематических клеток, которая получила название «дискриминационный центр» транспорта питательных веществ (рис. 3.6). Предположительно, этот центр участвует в контроле над перераспределением железа в растениях стратегии II.
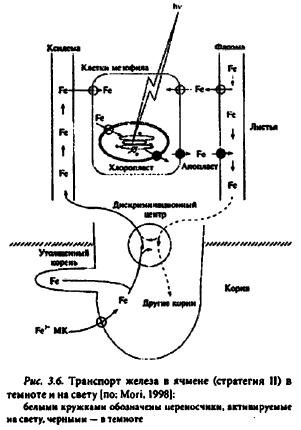
Транспорт Fe-фитосидсрофорных комплексов в побег зависит от условий освещения. Например, транспорт 59Fe из корней в полностью затемненные листья ячменя прекращается. Когда затеняли только среднюю часть листьев, поступление железа в мезофилл затемненных участков листовой пластинки уменьшалось, а транспорт 54Fe происходил в жилках листа. Следовательно, радиальный транспорт железа в листе из ксилемы к клеткам мезофилла регулируется светом. Возможно, светозависимый контроль за поступлением железа в клетки мезофилла осуществляют хлоропласты, в которых содержится основное количество железа в листе. Освещение хлоропластов ячменя в течение часа способствовало увеличению поглощения этими органеллами железа с 0,4 до 1,15 мкг/мг хлорофилла. Поглощение железа хлоропластами на свету почти полностью подавляется дихлорфенилдиметилмочевиной (10в-3 моль/л), значит, поглощение железа хлоропластами не связано напрямую с фитохромной системой. Конкретные механизмы транспорта железа в хлоропласт к настоящему времени изучены недостаточно.
В темноте хлоропласта не поглощают, а выделяют железо. Этот феномен лежит в основе ремобилизации железа а листьях, более интенсивной в темноте. Затемнение нижних листьев у Fe-дефииитных бобов способствует накоплению этого микроэлемента в верхних листьях и «излечиванию» растений от хлороза. Ремобилизация железа в листьях, вероятно, осуществляется следующим образом: хлоропласт → цитоплазма апопласт → флоэма.
Важную роль в доставке в ткани листа железа может иметь фотовосстановление комплексов трехвалентного железа с органическими кислотами за счет энергии света.
Проникновение меди из ксилемы в клетки листьев возможно в ионной или комплексной (никотианаминовой) форме. Соединения, участвующие в дальнейшем транспорте цинка, поступившего в листья с ксилемным соком, пока не изучены. У люпина белого транспортируемый по ксилеме 54Mn накапливался главным образом по периферии старых листьев, где скорость транспирации наибольшая. В растениях поглощенный селен трансформируется в селенаты и транспортируется по ксилеме. Предполагают, что растения запрограммированы направлять сульфаты и селенаты к растущим верхушечным листьям. Причем, селен лучше транспортируется в побег в форме селенатов, чем селенитов или органических соединений. По ксилеме передвижение соединений селена осуществляется без каких-либо их трансформаций.
У
A. bisulratus (гипераккумулятора селена) селенаты концентрировались преимущественно в старых листьях, а метилселеноцистеин — в молодых тканях. В старых листьях
A. bisulcatus более 80% от общего содержания серы и селена накапливалось в вакуолях, в молодых листьях 99% селена и 48% серы накапливалось в восстановленных формах. По-видимому, в растениях-гипераккумуляторах селена молодые ткани побега — основной донор органических форм этого элемента для других органов. У обычных растений
(В. juncea), обработанных селенатами, 80% селена (от общего содержания) в побеге и 60% в корнях оставались в форме селенатов. Очевидно, трансформация селена в органическую форму — важный компонент Se-толерантности растений.