Физиологические причины дефицита микроэлементов
Низкая подвижность микроэлементов в почве — не единственная причина, вызывающая у растений симптомы дефицита микроэлементов. Выявлено несколько факторов, снижающих эффективность поглощения растениями микроэлементов и вызывающих нарушение их транспорта. Наиболее важные среди них — повышенные концентрации в питательной среде бикарбонатов, нитратов, фосфатов и тяжелых металлов.
Бикарбонаты. Ключевая роль в регуляции обмена железа у растений стратегии I принадлежит бикарбонатам (HCO3-), входящим как составная часть в буферную систему карбонатных почв. Концентрация бикарбонатов в почвенном растворе зависит от величины pH, парциального давления CO2 в почвенном воздухе и растворимости CaCO3.
Выявлена сильная связь между концентрацией в почве HCO3- и симптомами дефицита железа у растений, особенно стратегии I. Переувлажнение и уплотнение почвы усугубляют заболевание растений хлорозом, что происходит вследствие повышения концентрации в почве бикарбонатов.
Механизм физиологического действия HCO3- связывают с регуляцией pH среды. Увеличение концентрации бикарбонатов в почве способствует не только повышению pH и снижению подвижности соединений железа в почве, но и нейтрализации продуцируемых корнями протонов и подщелачиванию ризосферы растений. В результате нарушаются функционирование Fe-релуктаз корня и поглощение железа корнями.
Однако концентрация железа в корнях растений в карбонатной почве может быть гораздо выше, чем у растений в кислой почве. Следовательно, признаки карбонатного хлороза — результат не только нарушений в поглощении железа корнями из почвы, но и в транспорте поглощенного железа из апопласта в симпласт корня. В присутствии бикарбонатов значения pH в апопласте корней и корневых волосков достигают 7. Однако в щелочной среде Fe3+-редуктазная активность корней подавлена, что приводит к аккумулированию в апопласте эпидермы плохо растворимых в воде оксидов и гидроксидов Fe3+. В этих условиях концентрация в апопласте железа достигает 2000 мкг/г сухого вещества. Причем часть указанных форм железа может быть мобилизована только после выдерживания корней в растворах с химическими восстановителями окисленных форм железа. В кислых условиях железо распределяется по тканям корня однороднее, его концентрации ниже. Такая иммобилизация в апопласте эпидермальных клеток корня железа приводит к нарушению транспорта этого микроэлемента по направлению к стеле корня и побегу растений.
Нарушения в поглощении железа корнем, вызванные бикарбонатами, негативна отражаются на последующем транспорте этого микроэлемента в побеги и его распределении в листьях. Нарушения в усвоении листьями железа возможны вследствие его инактивации при увеличивающихся в тканях этих органов значениях pH. Однако опытами с водными культурами подсолнечника эта точка зрения не подтверждена. Более того, в опытах с сахарной свеклой при дефиците железа происходило даже небольшое снижение величины pH (нa 0,3-0,4 единицы) ксилемного сока и апопластной жидкости. Причиной такого эффекта может быть повышенная активность Н+-АТФаз плазматической мембраны. В опытах с грушей значения pH увеличивались с 5,5-5,9 до 6,5-6,6. Правда, такое увеличение незначительно для индукции нарушений в поглощении железа клетками мезофилла листьев.
В целом реакция растений на воздействие бикарбонат-иона биологически специфична. Наибольшей устойчивостью характеризуются Fe-эффективные виды. Правда, так не считают Romheld с коллегами. Различия в мнениях могут быть связаны с выбором генотипа и экспериментальными условиями.
Нитраты. Обострение признаков карбонатного хлороза у растений может наблюдаться и при использовании нитратов в качестве источника азотного литания. Meханизмы действия нитратов и бикарбонатов на обмен железа у растений могут быть сходны и заключаются в регуляции реакции среды. Образование ОН и подщелачивание цитоплазмы клеток происходят в процессе поглощения нитратов или их восстановления. Поглощение нитратов осуществляется в симпорте с поглощением протонов (Н+-котранспорт), соответственно сопровождается подщелачиванием апопласта клеток корней, особенно в зоне корневых волосков или листьев. Бикарбонаты усиливают вызываемый нитратами эффект подщелачивания корней (значения pH увеличиваются на 0,20-0,25 вследствие нейтрализации бикарбонатами протонов, выделяемых в а поп ласт корней в результате работы Н+-АТФаз. Максимальное поражение листьев хлорозом зафиксировано при одновременном содержании в растворе нитратов и бикарбонатов.
B листьях подсолнечника при одновременном содержании нитратов и бикарбонатов в питательной среде отмечено увеличение значений pH анопласта и уменьшение концентрации хлорофилла. После исключения нитрата из состава среды подобные эффекты не проявлялись. Опрыскивание поверхности листьев растворами кислот (особенно лимонной) способствовало подкислению апопласта листьев и исчезновению признаков хлороза, индуцированных нитратами. Потребность в железе у подсолнечника, растущего на питательной среде с нитратом, выше, чем у растений на аммонийной среде, в 1,6 раза.
Вместе с тем утверждение о возможности инактивации железа в апопласте листьев а присутствии нитратов, как и бикарбонатов, не является бесспорным. До сих пор не доказано, что HCO3- транспортируется по ксилеме из корней в побег в концентрациях, достаточных для того, чтобы вызывать существенное увеличение значений pH сока ксилемы. Поэтому бикарбонаты и нитраты способны обострять вызываемый Fe-дефицитом хлороз, ограничивая приток железа к листьям вследствие высоких значений pH в корке. Предполагают также, что уровень pH — не самый важный фактор, контролирующий Fe3+-хелатредуцирующую активность. способную влиять на мобильность железа в листьях. Результаты воздействия pH на активность этого фермента зависят от того, какой выбран объект исследования: препараты плазматических мембран, протопласты, диски листьев.
Более существенным фактором, влияющим на Fе-хелатредуцирующую активность, является изменение отношения НАДФН/НАДФ+ и НFДН/НАД+ в клетках мезофилла. С увеличением этого отношения Fe3+-хелатредуцирукмцая активность на плазматической мембране возрастает. Кроме того, активность фермента зависит от отношения между содержанием органических кислот и железа. С увеличением молярного отношения цитрат/железо в апопластной жидкости Fe-дефицитных листьев поступление железа в клетки мезофилла может снижаться вследствие уменьшения активности Fe3+-хелатредуктазы. Активность Fe3-хeлатредуктазы в листьях Fe-достаточных и Fe-дефицитных растений зависит также от интенсивности освещения. С его увеличением поглощение железа (59Fe) листьями возрастает.
Видовые и сортовые различия в азотном обмене и нитратредуктазной активности растений, вероятно, взаимосвязаны с генотипической спецификой их Fe-адаптивных реакций.
Фосфаты. Мнения о характере влияния фосфатов на обмен железа у растений неоднозначны. В полевых опытах с длительным и интенсивным применением фосфорных удобрений не выявлено корреляции между содержанием в почве фосфора и степенью проявления у растений хлороза. В водных культурах повышенная концентрация фосфора в питательном растворе может индуцировать типичные признаки хлороза растений. Одна из причин иммобилизации железа заключается в образовании малорастворимых в воде фосфатов металла. При этом возможно подавление активности Fе-редуктаз корня. В природных условиях, пo мнению некоторых авторов, этот эффект практически не наблюдается, вероятно, вследствие пониженного содержания фосфора в области корневых систем и пространственной разобщенности зон поглощения этих элементов на поверхности корня. Однако при высоких дозах фосфорных удобрений у гибридного тополя обнаруживались характерные симптомы дефицита цинка и меди, не появлявшиеся при заблаговременном внесении в почву источников этих микроэлементов в форме солей и хелатов.
Антагонизм ионов. Обострение дефицита микроэлементов возможно вследствие антагонизма между микроэлементами и другими ионами, особенно ионами тяжелых металлов. Широко распространенный у риса недостаток цинка, а также меди, обнаруживается вследствие подавления поглощения этих микроэлементов железом и марганцем. Концентрация последних в затопленных для выращивания риса почвах обычно высокая, что объясняется низкими значениями Eh в этих условиях. В карбонатных почвах Пакистана у риса симптомы дефицита цинка отмечены на фоне незначительного увеличения подвижности этого микроэлемента. Применение цинковых удобрений на карбонатных почвах улучшало снабжение риса цинком и одновременно подавляло поглощение меди, что свидетельствует о проявлении Zn/Cu-антагонизма. Явление антагонизма между ионами необходимо учитывать в практике применения удобрений.
Под влиянием тяжелых металлов: меди, никеля, молибдена, цинка, марганца, подавлялась Fе-редуктазная активность корней. Наибольший ингибирующий эффект вызывали медь и никель. Толерантность к действию тяжелых металлов выше у растений стратегии I Fe-эффективных видов, характеризовавшихся наибольшими значениями релуктазной активности. Эффект ингибирования Fe-хелатредуктазной активности обнаружен в присутствии трехвалентных редких элементов (10 мкмоль/л): скандия (Sc), хрома (Cr), иттрия (Y) и лантана (La). Кроме того, эти элементы подавляли выделение корнями растений стратегии I (огурца) протонов. В форме комплексов с ЭДТА отрицательный эффект редких элементов не проявлялся. Возможно, редкие элементы ингибируют синтез этилена, играющего, как известно, регуляторную роль в реакциях растений на условиях Fе-дефицита. Кроме того, редкие элементы могут ингибировать рост корня и соответственно его реакции на условия Fе-дефицита.
Влияние кремния. Для большинства высших растений кремний (Si) — полезный химический элемент. Он способствует повышению механической прочности листьев и устойчивости растений к грибковым заболеваниям. В присутствии кремния растения лучше переносят неблагоприятные условия: дефицит влаги, несбалансированность питательных элементов, токсичность тяжелых металлов, засоление почв, действие экстремальных температур.
Многие эффекты, вызываемые кремнием, объясняют его модифицирующим !слиянием на сорбционные свойства клеток (клеточных стенок), где он может накапливаться в форме аморфного кремнезема и связываться различными органическими соединениями: липидами, белками, углеводами,органическими кислотами, лигнином, полисахаридами и др. Зафиксировано увеличение в присутствии кремния сорбции клеточными стенками марганца и, как следствие, устойчивости растений к его избытку в среде. Подобный же механизм лежит в основе положительного влияния на растения кремния в условиях избытка ионов алюминия (Al3+), устраняемого путем формирования Al-Si-комплексов. В форме силикатов возможна иммобилизация избытка ионов цинка в цитоплазме растительной клетки, что установлено на примере устойчивого к повышенным концентрациям цинка вида
Cardaminopsis halleri. В присутствии кремния ослабляется негативное воздействие на растения кадмия вследствие ограничения транспорта последнего в побеги. В условиях засоленных почв кремний способен препятствовать накоплению в побегах натрия.
Очевидно, при избыточном содержании в среде многих химических элементов кремний полезен для растений. Его соединения способны адсорбировать ионы токсичных элементов, ограничивая их мобильность как в среде обитания, так к в тканях растений. Действие кремния на растения при недостатке химических элементов, особенно необходимых в небольшом количестве, например, микроэлементов, до сих пор не исследовано.
В выполненных нами исследованиях установлено, что влияние кремния на концентрацию в листьях пигментов (хлорофиллов а, b, каротиноидов) проявлялось при недостатке железа и было двойственным по своей направленности. С одной стороны, растворы с кремнием усугубляли хлороз, заметно ускоряя индуцированное Fe-дефицитом снижение концентрации пигментов в листьях. Такие случаи зафиксированы у злаков: ячменя, кукурузы (табл. 5.8), а также двудольных растений: огурца, тыквы с отделенными семядолями (табл. 5.9) или с семядолями, потерявшими свои функции вследствие естественного старения: пожелтевшими, усыхающими (табл. 5.10).
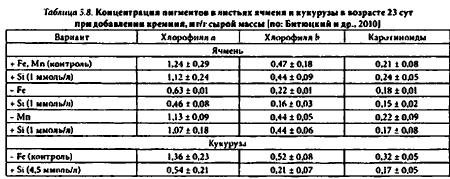
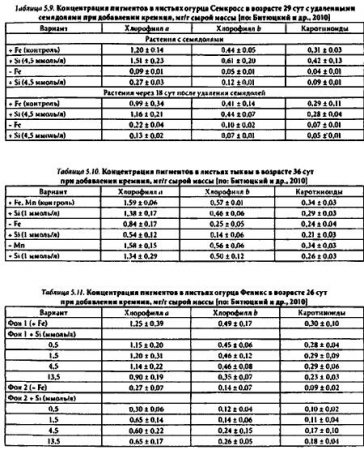
С другой стороны, выявлены факты торможения в присутствии кремния развития хлороза, что отмечалось исключительно у молодых двудольных растений с интактными зелеными семядолями (табл. 5.11;). В условиях нормального снабжения растений микроэлементами, а также Мn-дефицита концентрация пигментов в листьях оставалась стабильном независимо от содержания кремния в среде (табл. 5.8-5.11).
Обострение хлороза, вызываемое кремнием, можно объяснить нарушениями в рециркуляции в растениях эндогенного железа вследствие его связывания (иммобилизации) кремнекислыми группами клеток. О реальности подобных нарушений свидетельствуют приведенные факты уменьшения у Si-обработанных растений концентрации железа в соке побегов (табл. 5.12). Описано аналогичное снижение концентрации марганца и бора, в отличие от концентрации цинка, вызываемое кремнием в межклеточной жидкости листьев огурца. Такое снижение — следствие увеличения сорбции микроэлементов, по крайней мере марганца, клеточными стенками.
Стабильность силикатных комплексов с металлами специфична. СMo2+ и Mg2+ формируются относительно устойчивые комплексные соединения, а с Zn2+ к К+ — неустойчивые. Устойчивые комплексы могут ограничивать доступность питательных элементов организмам, вызывая нарушения в их росте. Например, причиной уменьшения в присутствии кремния скорости роста культур
Saccharomyces cerevisiae в питательной среде с низким содержанием магния, называют формирование с ионами этого элемента при его недостатке в среде относительно стабильных комплексных Si-Mg-соединений.
Согласно результатам наших исследований (табл. 5.12) клетки Si-обработанных растений способны связывать железо с прочностью, достаточной для ограничения его перемещения по растению. Однако такое связывание возможно только в условиях недостатка железа. При бесперебойном снабжении растений этим микроэлементом его возможная сорбция кремнекислыми группами клеток физиологически несущественна. По крайней мере, она (сорбция) не отражалась ни на концентрации эндогенного железа в стебле, ни на концентрации пигментов в листьях.