Электроды для определения рН
Для потенциометрического определения pH в почвенных вытяжках, суспензиях, растворах, а также в биологических средах и других объектах пригодны любые индикаторные электроды, потенциал которых прямо или косвенно зависит от активности водородных ионов или является функцией величины pH: ε = f (pH). Вместе с тем электрод должен быть достаточно селективен, т. е. на его потенциал не должны заметно влиять другие компоненты изучаемой системы. Наибольшее практическое значение имеют в этом отношении водородный, хингидронный и стеклянный электроды. Благодаря развитию потенциометрической техники определение pH со стеклянным электродом стало основным методом в агрохимических и других исследованиях. Хингидронный электрод употребляют лишь при отсутствии ламповых потенциометров. Водородный электрод редко применяется для непосредственных аналитических целей, но он остается основным стандартным электродом.
Водородный электрод (рис. 1, А). Потенциал водородного электрода обусловлен реакцией:
H2 ⇄ 2Н+ + 2 е;
величина его может быть выражена уравнением
ε = -2,303RT/nF pH или, при 20°С, ε = -0,0581рН.
Потенциал нормального водородного электрода принимается равным нулю при любых температурах, а его величина лежит в основе шкалы электродных потенциалов.
Если имеется электрод сравнения с точно известным потенциалом, то измеренная величина потенциала водородного электрода позволяет непосредственно вычислить величину pH. При 20°С значение pH находят:
рН = э.д.с. - εср / 0,0581,
где э.д.с. — электродвижущая сила элемента, состоящего из электрода сравнения с потенциалом εср, и водородного электрода.
Коэффициент 2,303 RT/nF, входящий в вышеприведенное уравнение, является коэффициентом уравнения Нернста и используется во всех аналогичных формулах. Его величина при различных температурах приведена в табл. 5.
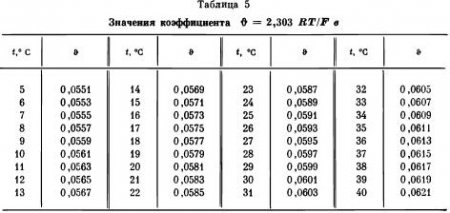
Для приготовления водородного электрода берут гладкую платиновую проволоку или пластинку, впаянные в стеклянные трубки. Поверхность платины тщательно очищают и промывают горячим раствором хромовой смеси, а затем дистиллированной водой. Промытый водой электрод оставляют в чистой дистиллированной воде на ночь. Затем приступают к платинированию электрода. С этой целью в 100 мл воды растворяют 2—3 г PtCl4 и 0,02 г (CH3COO)2Pb. В этот раствор пускают подлежащий платинированию электрод и соединяют его с отрицательным полюсом аккумулятора на 2—4 в. Анодом служит также платиновая пластинка или проволока. Через раствор пропускают ток, регулируя его силу таким образом, чтобы на аноде непрерывно, но не слишком быстро, выделялись пузырьки газа. Через 4—6 мин. поверхность электрода покрывается ровным бархатисто-черным слоем губчатой платины. Платинированный электрод промывают дистиллированной водой и снова подвергают катодной поляризации, но уже в 0,05 н. H2SO4, чтобы удалить адсорбированные ионы Cl. Готовый электрод тщательно промывают дистиллированной водой и хранят погруженным в воду (рис. 1).
Для проведения измерений в электродный сосуд наливают буферный раствор с известным значением pH или исследуемый раствор с неизвестным pH так, чтобы полностью покрыть раствором платинированную поверхность. Этот раствор насыщают водородом, пропуская последний с такой скоростью, чтобы можно было считать пузырьки газа. После насыщения водородом измеряют потенциал электрода; затем повторно насыщают водородом и повторяют всю процедуру до тех пор, пока не получат двух постоянных значений э. д. с.
Необходимый для насыщения электрода водород получают с помощью аппарата Киппа. С этой целью в аппарат Киппа загружают гранулированный металлический цинк и наливают 25 %-ную H2SO4. Для очистки выделяющийся водород пропускают через склянки Тищенко или Дрекселя, последовательно заполненные следующими растворами: 1) 5%-ный KMnO4 в 5 %-ной H2SO4; 2) 10%-ный Pb(GH3COO)2; 3) 10%-ный раствор пирогаллола в 10%-ном КОН; 4) 0,1 н. H2SO4.
В нормально работающем аппарате Киппа серная кислота покрывает только нижний слой гранулированного цинка. Выделяющийся в результате бурной реакции водород поддерживает требуемое давление. Если кислота полностью покрывает слой цинка, а реакция идет вяло, то аппарат Киппа необходимо перезарядить. Свежезаряженному аппарату Киппа необходимо дать поработать вхолостую 15—20 мин., чтобы полностью заместить водородом находившийся в нем воздух.
Теоретически водородный электрод пригоден для измерения pH в диапазоне от 0 до 14. Однако этот электрод очень чувствителен к присутствию многих соединений, часто встречающихся в почвах и биологических средах. Присутствие сильных окислителей и восстановителей искажает показания электрода; отрицательно влияют соли азотной, хромовой, хлорноватой кислот, соединения закисного и окисного железа, сера, сульфиды, сулема, аммиак, амины. Большие ошибки возникают в присутствии поверхностно-активных и коллоидных веществ. Особенно сильное влияние можно ожидать в почвенных суспензиях, всегда содержащих гумусовые вещества и минеральные коллоиды. Все это заставляет пользоваться водородным электродом преимущественно для целей стандартизации. В частности, при проверке потенциалов электродов сравнения (полуэлементов).
Хингидронный электрод (см. рис. 1, Б). Хингидронный электрод представляет собой платиновую пластинку или проволоку в насыщенном растворе хингидрона. Строго говоря, его потенциал является потенциалом окислительно-восстановительной системы:
Ho поскольку концентрация аниона гидрохинона зависит от активности водородных ионов, то в конечном итоге потенциал электрода является функцией pH. В полной форме потенциал хингидронного электрода можно выразить уравнением:
где ε0 — потенциал нормального хингидронного электрода, а K1 и K2 — первая и вторая константы диссоциации гидрохинона. Относя величину K1K2 из знаменателя в постоянную уравнения и пренебрегая малыми величинами K1аН+ и K1K2 в числителе, получим:
ε = ε0 - υрН
Хингидронный электрод, как и водородный, имеет ряд ограничений. Прежде всего предел измеряемых с его помощью величин pH ограничен величинами pH около 8. Это обусловлено как упомянутыми выше упрощениями при выводе формулы, так и окислением гидрохинона в щелочной среде кислородом воздуха.
Большие ошибки могут быть вызваны присутствием окислителей и восстановителей, что и понятно, так как потенциал электрода по своей природе является окислительно-восстановительным. По указанным причинам хингидронный электрод нельзя применять для анализа щелочных почв с pH более 8 (солонцы, содовые солончаки) и для глеевых или сильнооглеенных почв.
Несмотря на указанные недостатки, хингидронный электрод еще совсем недавно был основным электродом при определении реакции почв, а в некоторых случаях он используется еще и сейчас. Как правило, он находит применение в полевых условиях, когда нет возможности воспользоваться электронными потенциометрами. В полевых условиях он может быть иногда весьма удобен и как электрод сравнения, например при измерении окислительно-восстановительных потенциалов почв.
Стеклянный электрод (см. рис. 1, В—Е). Стеклянный электрод меньше всего зависит от состава раствора, не отравляется как водородный электрод, не боится присутствия окислителей и восстановителей и пригоден для работы в значительно более широком интервале pH, чем хингидронный электрод. Он прост в обращении и удобен в работе. По этим причинам стеклянный электрод стал сейчас основным индикаторным электродом при измерениях pH, хотя он и требует обязательной градуировки.
Распространению стеклянных электродов немало способствовало создание современных электронных потенциометров. Использовавшиеся в начальный период конденсаторные и баллистические схемы с зеркальными гальванометрами были крайне неудобны в работе, что долгое время сдерживало внедрение стеклянных электродов в практику почвенно-агрохимических работ. Сейчас эти трудности полностью преодолены.
Теория возникновения скачка потенциала на границе стекло — раствор довольно сложна. Сейчас установлено, что стеклянные электроды можно рассматривать как катионообменные мембраны, высокоселективные к различным катионам. В зависимости от состава стекло может обладать различными функциями: или простой Н+-функцией, или функциями щелочных, щелочноземельных и даже органических катионов.
Электроды, чувствительные к водородным ионам, были открыты в начале века Кремером и Габером и Клеменсиевичем. Общая теория их была разработана Б.П. Никольским, затем развита М.М. Шульцем и Дж. Эйзенманом. Согласно взглядам Б.П. Никольского, в простом случае потенциал стеклянного электрода может быть выражен уравнением
ε = ε0 + υlg (аH+ + KaNа+),
где К — константа обмена ионов H+ и Na+ между стеклом и раствором. Если КаNa+ ≪ аH+, то
ε = ε0 + υlg аH+ = ε0 - υpH.
Аналогично рассматриваются уравнения и для электродов с другими функциями. Функция электрода определяется составом стекла и в известных пределах может быть предсказана теоретически.
К недостаткам стеклянного электрода относится потенциал асимметрии, который может быть сведен к минимуму длительным вымачиванием. Второй недостаток связан с тем, что всякий стеклянный электрод до некоторой степени полифункционален, как это, например, видно из приведенного выше уравнения. Поэтому интервал измеряемых величин pH и прямолинейность функции ε — pH зависят от состава стекла и состава исследуемого раствора. Наконец, к числу недостатков электрода следует причислить и высокое омическое сопротивление.
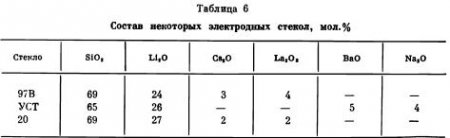
Промышленность выпускает большой набор простых и комбинированных стеклянных электродов, а состав стекол меняется в довольно широких пределах. Состав некоторых стекол приведен в табл. 6.
Стеклянные электроды различаются не только по составу стекол, но и многими другими характеристиками: формой, размерами, типом вспомогательного электрода, гибкого вывода и т. п. Конструктивно стеклянный электрод чаще всего изготовляют в виде шарика, толщина стенок которого составляет 0,05—0,1 мм; шарик выдувается на конце стеклянной трубки. Стеклянный электрод заполняют 0,1 н. HCl или подходящим буферным раствором. В этот раствор погружают вспомогательный стандартный электрод (чаще всего хлорсеребряный), вывод от которого подсоединяется к потенциометру. В комбинированных электродах внутри стеклянного электрода размещают и каломельный полуэлемент сравнения. Контакт полуэлемента с раствором осуществляется через микротрещину. В этом случае выводной кабель заканчивается штекером для подключения к потенциометру.
Характеристики некоторых типов электродов отечественного и зарубежного производства приведены в табл. 7 и 8. Наименование типа электрода, приведенное в табл. 7, включает следующие обозначения. Первые три буквы обозначают тип и назначение электрода (ЭСЛ — электрод стеклянный лабораторный). Четвертый знак указывает марку электродного стекла (1 — стекло УСТ, 4 — стекло № 20 и т. д.). Пятый знак — тип вспомогательного электрода (1 — хлорсеребряный; 3 — то же, в ацетатном буферном растворе и т. д.). Шестой знак указывает на особенности заполняющего раствора. Буквой Г обозначены морозостойкие до -25° С растворы. Седьмой и восьмой знаки обозначают типы конструктивного исполнения.
Устройство современных промышленных электродов ясно из рис. 1. Такие электроды поступают в продажу с подробным описанием устройства и паспортом, в котором приведены все важнейшие характеристики.
Стеклянные электроды для измерения pH нетрудно и самостоятельно изготовить в любой лаборатории, но мы не приводим соответствующих рекомендаций, так как они были изложены ранее, а промышленность обеспечивает практически полностью потребности в электродах всех производственных и научно-исследовательских организаций.