Определение форм фосфатов почвы по изотермам растворимости
Формы почвенных фосфатов могут быть определены также с помощью изотерм растворимости чистых фосфорных соединений. Известно, что растворимость фосфатов зависит от pH. Используя данные табл. 13, Линдсей и Морено выразили растворимость чистых фосфорных соединений графически в виде функции рН2РО4 от pH. Для выражения растворимости варисцита, стренгита и фторапатита делается допущение, что активности ионов Al3+, Fe3+ и F- в почвенном растворе определяются условиями равновесия с содержащимися в твердых фазах гиббситом, гетитом и флюоритом как наиболее стабильными соединениями в почвах. При построении изотерм растворимости фосфатов кальция следует учитывать концентрацию кальция в растворе. Если активности ионов определяются в вытяжке 0,01 M CaCl2, то концентрация кальция будет равна 0,01 M/л (рСа = 2,0). С учетом этих допущений уравнения, используемые для построения изотерм растворимости фосфатов, имеют такой вид:

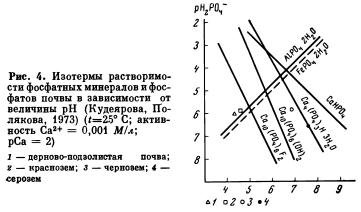
Путем подстановки различных значений pH в уравнения (38—43) находится величина рН2РO4, которая откладывается по оси ординат, по оси абсцисс откладывается величина pH. По нескольким точкам строятся изотермы растворимости чистых фосфорных соединений (рис. 4). Используя данные рН2РO4 и pH, определенные экспериментально в 0,01 MCaCl2 вытяжках из почв, и нанеся их на диаграмму растворимости, можно сравнить растворимость почвенных фосфатов с растворимостью известных фосфорных соединений. На рис. 4 показано существенное различие в формах фосфатов, содержащихся в различных типах почв. Так, в дерново-подзолистой почве и красноземе фосфатное равновесие устанавливается с фосфатами алюминия типа варисцита, в черноземе — с фосфатами кальция, растворимость которых больше, чем у гидроксилапатита, но меньше, чем у октакальцийфосфата. В сероземе основным фосфорным соединением был октакальцийфосфат.
Изотермы растворимости различных фосфорных соединений можно выразить также в виде функции рР от pH; для соединений фосфатов кальция — с помощью отношения фосфатного и известкового потенциалов, для соединения фосфатов алюминия и железа — в виде функций рН2РO4 от 2рН — рА1 или 2рН — pFe соответственно и т. п.
В литературе имеются данные, указывающие на то, что нет хорошего соответствия между концентрацией фосфора в почвенном растворе и концентрацией, предсказываемой из значений произведений растворимости. Исследователи объясняют это тем, что существуют, например, две константы рК пр для гидроксилапатита и октакальцийфосфата, которые соответствуют случаю достижения равновесия при их осаждении и при растворении.
Дальнейшее осложнение при установлении рК пр обусловлено сильным влиянием примесей на растворимость различных фосфорных соединений. Так, было показано, что чистый гидроксилапатит подчиняется правилу произведения растворимости, но в присутствии небольших количеств карбоната кальция правило нарушается. Большое влияние оказывает также возможное комплексообразование в растворе. Поэтому несоответствие между концентрацией фосфора в почвенном растворе и рК пр чистых препаратов фосфатов еще не означает, что эти соединения не определяют концентрацию фосфора в растворе.
Использование констант и изотерм произведения растворимости не дает абсолютных величин содержания различных форм фосфорных соединений в почвах, но дает им качественную оценку, показывающую степень их растворимости и возможные превращения в различных почвенных условиях.