Электроды сравнения
Потенциал отдельно взятого электрода измерить невозможно. Поэтому в качестве нуля шкалы потенциалов принят потенциал нормального водородного электрода, а в качестве электродов сравнения (полуэлементов) используют как водородный электрод, так и другие электроды со стабильными или легковоспроизводимыми потенциалами. Такими электродами чаще всего служат каломельный электрод, хлорсеребряный электрод и хингидронный электрод.
Водородный электрод, взятый в качестве
полуэлемента, ничем не отличается от обычного водородного электрода, но заполнен он буферным раствором с известным значением pH. Водородный электрод мало удобен при массовых измерениях и поэтому его используют преимущественно для однократного установления потенциала вторичного полуэлемента, например, каломельного электрода. Потенциалы водородного электрода при различных значениях pH приведены в табл. 9.
Чаще используется
хингидронный полуэлемент, который служит и как индикаторный электрод, и как электрод сравнения. В последнем качестве он обычен в схемах, когда величины pH измеряют хингидронным электродом на потенциометрах типа П-4, П-5 или на сборных схемах. В этом случае составляется хингидрон-хингидронный элемент. Хингидронный полуэлемент часто бывает удобен и при измерении ОВП, особенно в полевых условиях, когда, имея запас буферного раствора и сухой хингидрон, можно в любой момент приготовить электрод сравнения с достаточно хорошо воспроизводимым потенциалом.
Хингидронный электрод, используемый в качестве полуэлемента, ничем не отличается от обычного хингидронного электрода. Разница лишь в том, что исследуемый раствор заменяется стандартным буферным раствором с известным значением pH. Потенциал такого электрода может быть легко вычислен или найден по таблицам. Буферный раствор для заполнения хингидронного электрода сравнения выбирается с таким расчетом, чтобы в ходе измерений как можно реже приходилось переключать полюса элемента. Поскольку в почвенно-агрохимических исследованиях значения pH редко бывают ниже 2,5—3, то для таких целей наиболее удобен буферный раствор Вайбеля с pH 2,04 или Кларка и Лэбса с pH 2,0 или 2,2. Тот же буферный раствор удобен и тогда, когда хингидронный полуэлемент используется как электрод сравнения для измерения ОВП. Его потенциал при pH 2,0 равен 0,587 в при 20° С, что, как правило, выше реально измеряемых ОВП почв в природе или модельных опытах.
Потенциал хингидронного электрода можно вычислить, если известен потенциал нормального хингидронного электрода, pH буферного раствора и температура. Потенциал нормального хингидронного электрода зависит только от температуры и определяется формулой
ε0, хинг = 0,6990 + 0,00074 (25° - t).
Значения нормального потенциала для некоторых температур приведены в табл. 10. Потенциал любого хингидронного электрода вычисляется по приведенной выше формуле и приведен в табл. 11 для 20° С.
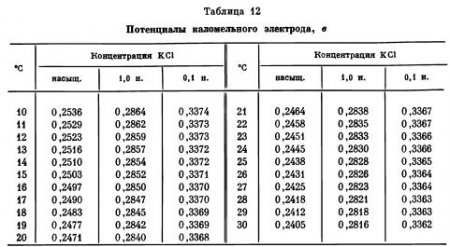
Наиболее распространен в электрохимических работах
каломельный электрод сравнения. Это ртутный электрод, находящийся в равновесии с катионами Hg2+ в насыщенном растворе каломели Hg2Cl2; в раствор каломели добавляют хлористый калий, влияющий на растворимость каломели, так как имеет с ней одноименный ион. В зависимости от концентрации KCl различают насыщенный, нормальный и децинормальный каломельные электроды, различающиеся величинами потенциалов, а также устойчивостью потенциалов во времени и по отношению к изменению температуры. Наиболее устойчив во времени насыщенный каломельный электрод, концентрация KCl в котором остается постоянной даже при частичной потере воды за счет испарения. Ho поскольку растворимость KCl сильно зависит от температуры, то у насыщенного каломельного электрода и наибольший температурный коэффициент (табл. 12). Потенциал каломельного электрода определяется концентрацией ионов ртути в растворе, но так как последняя связана с концентрацией ионов хлора, то потенциал каломельного электрода можно выразить и как функцию активности хлор-ионов:
ε = ε0 — 0,0581 lga Cl-,
т. е. фактически он является электродом второго рода.
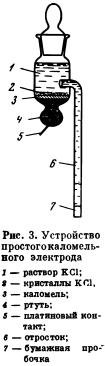
Приготовление каломельных электродов несложно и легко осуществимо в любой лаборатории. Для различных по характеру исследований было предложено несколько конструкций каломельных электродов. Ниже приведено описание только одного вида электрода (рис. 3), который можно использовать в самых различных условиях как при потенциометрических, так и при полярографических и других работах. Описываемый электродный сосуд имеет в нижней части шарообразную форму. В дно шарообразной части сосуда впаяна платиновая проволока, через которую осуществляется контакт со ртутью. Другой конец платиновой проволоки сваривается с медным проводником; последний подводится к потенциометру. Перед заполнением сосуд и платиновый контакт тщательно промывают концентрированной серной кислотой и дистиллированной водой. Затем часть платиновой проволоки, находящуюся внутри сосуда, амальгамируют. Для этого в сосуд наливают раствор Hg2(NO3)2, подкисленный азотной кислотой, а наружный конец платиновой проволоки подсоединяют к отрицательному полюсу аккумулятора на 2 в. В качестве анода используют также платиновую проволоку, которую присоединяют к положительному полюсу того же аккумулятора, а конец ее опускают в сосуд. Через раствор пропускают ток примерно в течение 1 мин.; за это время платиновая проволока, впаянная в стенку сосуда, покрывается серым налетом ртути. По окончании амальгамирования раствор из сосуда выливают, а сосуд тщательно промывают дистиллированной водой, ополаскивают бидистиллированной водой и высушивают.
В сухой сосуд наливают ртуть с таким расчетом, чтобы тонкий слой ртути находился и в цилиндрической части сосуда. Поверх ртути наливают немного суспензии Hg2Cla в растворе хлорида калия; концентрация KCl должна соответствовать виду приготовляемого электрода. Толщина слоя каломели на поверхности ртути должна быть 1—2 мм. Затем отверстие соединительного отростка закрывают и наливают в сосуд (если готовят насыщенный каломельный электрод) насыщенный раствор KCl, предварительно нагретый до 60°. Сосуд закрывают притертой пробкой. Осторожно приоткрывая пробку, заполняют жидкостью соединительный отросток и пробку снова закрывают. Отверстие соединительного отростка осторожно закрывают пробочкой из туго свернутой фильтровальной бумаги; часть пробочки, оставшуюся вне отростка, срезают лезвием бритвы.
По охлаждении раствора из него выделяются кристаллы KCl, которые оседают поверх слоя каломели. Таким образом, в готовом электроде на поверхности ртути расположен слой каломели, затем слой кристаллов KCl и наконец насыщенный раствор хлорида калия. Спустя сутки электрод пригоден для работы. В сосудах иной формы электрод готовится аналогично, несколько меняется только техника заполнения сосуда.
Суспензию каломели для заполнения электрода готовят из препарата квалификации х. ч. С этой целью растирают Hg2Cl2 с насыщенным раствором хлорида калия и несколькими капельками ртути (для восстановления следов ртути-II) в агатовой ступке до получения гомогенной массы, переносят с помощью насыщенного раствора KCl в склянку и 6 час. взбалтывают на ротаторе. Раствор хлорида калия над осадком Hg2Cl2 сливают, и осадок несколько раз промывают свежими порциями насыщенного раствора KCl.
Существенное значение для приготовления каломельных электродов с потенциалами, максимально близкими к табличным, имеет чистота ртути и KCl. Хлорид калия перед началом работы дважды перекристаллизовывают и затем уже готовят насыщенный раствор. Растворимость KCl сильно зависит от температуры и составляет при 20° С примерно 34,4 г на 100 мл, а при 60° С — около 46 г на 100 мл. Поэтому для приготовления горячего насыщенного раствора KCl берут 45—50 г KCl и при нагревании растворяют в 100 мл воды. Этим раствором заполняют электрод. При остывании раствора за счет уменьшения растворимости выпадают кристаллы KCl. He следует готовить насыщенный раствор слишком высокой концентрации (при 80—90°), иначе при остывании выпадает слишком много кристаллов KCl и весь электрод, включая соединительные отростки, оказывается забитым ими.
Очистка ртути описана во многих руководствах. Обычно бывает достаточным «фильтрование» ртути через тонкое отверстие в бумажном фильтре. Через такое отверстие ртуть вытекает мелкими каплями в 5%-ный раствор HNO3. После двух-трехкратного промывания ртуть пропускают через дистиллированную воду. Часть примесей задерживается фильтровальной бумагой, часть растворяется азотной кислотой. Если ртуть очень грязная, ее предварительно несколько раз промывают азотной кислотой, встряхивая в делительной воронке. Промытую ртуть собирают в сухую склянку с притертой пробкой и высушивают, проводя по ее поверхности полоской фильтровальной бумаги.