Способы определения рН почв и почвенных суспензий
Прежде чем приступать к определениям, необходимо выбрать условия измерений; сюда входят выбор стандартного состояния (или подготовка почвы), выбор электрода и измерительного прибора.
Подготовка почвы и приготовление суспензии. В практике принято определять pH образцов почв, предварительно собранных в поле и траспортированных в лабораторию. При этом неизбежно нарушается естественное состояние почвы; один из сильно влияющих факторов — высушивание почвы. Для приготовления водных вытяжек и суспензий многие авторы рекомендуют пользоваться воздушно-сухими образцами. В частности, White нашел, что высушивание щелочных почв в термостате снижает pH на 0,6 единицы. По другим данным, сушка образцов разными способами и хранение их в течение 5 месяцев не повлияли на результаты. Есть также наблюдения, что и измельчение почв, во всяком случае щелочных, снижает pH. В связи с этим предлагалось вместо сушки и растирания прибегать к просеиванию еще сырых почв через сито с отверстиями 2 мм. Методические исследования в этом направлении еще не закончены.
Для получения сопоставимых результатов в настоящее время наиболее правильно пользоваться воздушно-сухими образцами, просеянными после разминания через сито с отверстиями диаметром 1 мм. Эти стандартные условия могут быть изменены при специальных исследованиях, когда важно уловить тонкие изменения pH под влиянием быстро сменяющихся факторов. В таких случаях (но не при массовых обследованиях) следует отдать предпочтение сырым образцам почвы. Влажность сырых почв существенно не изменяет соотношения почва: раствор в ходе приготовления суспензии; поэтому, как правило, ее можно не принимать во внимание.
Различные рекомендации даются также по таким вопросам, как соотношение почва: раствор и время взаимодействия почвы с раствором. Данные о влиянии разбавления довольно противоречивы. По последним работам Шахтшабеля, различия pH при изменении отношения почва: раствор от 1 : 2,5 до 1:1 составляют всего 0,1 единиц pH. Более значительные сдвиги отмечались для более узких соотношений. Так же как и в предыдущем случае, для массовых стандартных измерений следует принять обычное соотношение почва: раствор = 1 : 2,5, хотя в специальных исследованиях это отношение может быть изменено, но отклонения от стандарта должны быть оговорены особо.
Результаты измерения pH зависят, наконец, и от времени взаимодействия почвы с раствором. Было, например, показано что в суспензии 0,01 M CaCl2 величина pH повышается от 5,4 до 6,1, если время встряхивания суспензии увеличить от 2 до 168 час.; последний автор рекомендует определять pH в течение часа после приготовления суспензии, хотя были высказаны и многие другие рекомендации: 5-минутное взбалтывание, настаивание 10—15 мин. при периодическом встряхивании, суточное взаимодействие. Вполне удовлетворительные и сопоставимые результаты получаются при 5-минутном встряхивании на ротаторе, что и можно рекомендовать в качестве стандарта.
Требует стандартизации и характер самой вытяжки. В частности, в каких случаях следует пользоваться вытяжкой, в каких — суспензией. Известно, что в практике почвенно-агрохимических исследований производят следующие виды измерений: 1) pH водной вытяжки; 2) pH водной суспензии; 3) pH солевой вытяжки; 4) pH солевой суспензии.
Различие результатов, получаемых при анализе вытяжек и суспензий, ранее связывалось с так называемым суспензионным эффектом (иногда называют эффектом Вигнера). Предполагалось, что в почвенной суспензии концентрация ионов H+ выше, чем в растворе за счет Донвановского равновесия. Подобного рода явления действительно могли иметь место при двух условиях: наличие полупроницаемой мембраны (границы раздела двух фаз) и возможность определения концентрации, а не активности H+-ионов. При анализе почвенных суспензий граница между фазами (принимая во внимание макроскопические размеры электродов) не может быть обнаружена. Кроме того, в состоянии равновесия активность H+-ионов должна быть одинаковой во всем объеме жидкой фазы, а при отсутствии скачка потенциала между жидкой фазой и частицами твердых фаз — и во всех фазах системы. Поэтому «суспензионный эффект» не должен возникать при анализе почвенных суспензий. Наблюдаемые иногда различия результатов измерений следует отнести не за счет суспензионного эффекта, а за счет диффузионного потенциала, поскольку заряженные частицы суспензии неодинаково влияют на диффузию ионов К+ и Cl- из каломельного электрода.
He наблюдали суспензионный эффект при работе со стеклянным электродом и другие исследователи. Более того, в ряде случаев pH суспензии оказывался выше, чем pH центрифугата. Отсюда следует, что рационально проводить только одно измерение.
Наиболее точные результаты могут быть получены для вытяжек, тогда как при анализе суспензий необходимо применять меры для устранения влияния диффузионного потенциала. Это легко осуществимо для солевых вытяжек, когда избыток соли способствует коагуляции коллоидов и позволяет получить совершенно прозрачные вытяжки. Прозрачные водные вытяжки получить очень трудно, и для массовых измерений можно рекомендовать ограничиться стандартным приемом: центрифугирование суспензии при 6000 об/мин в течение 15 мин. Полученные таким способом вытяжки из многих почв заметно опалесцируют.
Принято считать, что водная вытяжка характеризует реакцию почвенного раствора, а солевая — обменную (потенциальную) кислотность. Поэтому солевая вытяжка естественно пригодна лишь для почв, содержащих обменные ионы H+ или Al3+, тогда как в присутствии CaCO3 и сильных кислот может оказаться, что водная вытяжка будет более кислая, чем солевая. Есть также небезинтересные данные, согласно которым, между величинами pH в водных и солевых вытяжках существует строгая зависимость. Шахтшабель, сопоставляя pH в суспензиях почв на основе 0,01 M CaCl2, 0,1 M KCl, 1,0 M KCl и водной суспензии, установил следующие зависимости. В лёссовых почвах pH водных суспензий были выше pH суспензий в 0,01 M CaCl2 на 0,56 единиц; в суспензии 0,1 M KCl — меньше на 0,02 единицы pH и в суспензии 1,0 M KCl — меньше на 0,27 единиц pH, чем в суспензии 0,01 M CaCl2. В супесчаных почвах различия оказались несколько иными по абсолютной величине. Высокую корреляцию величин pH в водных и 0,01 M CaCl2 вытяжках отмечали и другие. Если такие связи окажутся устойчивыми и функционально обусловленными, это, может быть, позволит в будущем ограничиться анализом только одной какой-либо вытяжки.
Подводя итоги сказанному, можно прийти к следующим стандартным условиям приготовления вытяжек. Для анализа берут воздушно-сухие образцы почвы, разминают и просеивают через сито с отверстиями диаметром 1 мм. К навеске почвы приливают такой объем воды или 1,0 н. KCl, чтобы отношение почва : раствор составило 1 : 2,5. Колбочку со смесью закрывают пробкой и встряхивают на ротаторе 5 мин. Затем, если определяется pH водной вытяжки, суспензию переносят в центрифужные пробирки, последние попарно уравновешивают и суспензию центрифугируют 15 мин. при 6000 об/мин. В случае солевой вытяжки суспензии просто дают отстояться и для определения pH берут часть надосадочной жидкости. Для приготовления вытяжек используется только бидистиллированная вода, прокипяченная для удаления CO3 и хранящаяся изолированной от атмосферного воздуха.
Выбор электрода и измерительного прибора. Два основных условия ограничивают применение отдельных видов электродов и потенциометров: диапазон измеряемых величин pH и состав почвенных вытяжек или суспензий. Реакция почв, а точнее почвенных растворов и вытяжек, обусловлена избыточным содержанием ионов H+ или ОН-, происхождение которых может быть различным. Источниками водородных ионов могут быть самые простые системы, например угольная кислота, образующаяся при растворении CO2 в почвенном растворе. Исходя из того, что CO2 всегда присутствует в атмосферном и почвенном воздухе, мы должны рассматривать значение pH, равное 7, не как характеристику нейтральной почвы, а как почвы, в которой осуществляется слабое накопление оснований. Другими источниками H+ служат неспецифические органические кислоты, фульвокислоты и гуминовые кислоты. Концентрация кислот в почвенных растворах обычно невелика, а степень их диссоциации, как правило, низка, и поэтому обусловленная органическими кислотами реакция среды редко бывает ниже 3—4. Подкисляющее действие могут оказать поглощенные водородные ионы, а также различные гидролитически кислые соединения; широко известна, например, роль ионов алюминия:
Al3+ + 3Н2О → Al(OH)3 + 3Н+.
В довольно редких случаях (месторождения серы, горные выработки и отвалы) могут накапливаться минеральные кислоты, особенно серная. В этих случаях pH даже водных вытяжек бывает сильно понижен.
Нейтральная или слабощелочная среда в почве связана чаще всего с карбонатами кальция. Накопление соды приводит к повышению pH до 8,5—10; значительное подщелачивание иногда возможно и за счет органических оснований. Теоретический и практический опыт показывают, что при исследовании естественных почв диапазон измеряемых значений pH водных и солевых суспензий находится примерно в пределах от 2—3 до 10—11. Более кислые или более щелочные условия в природной обстановке редки, но в лабораторной практике встречаются довольно часто, что приходится учитывать при выборе инструмента исследования. Для широких агрохимических и почвенных анализов вполне можно ограничиться диапазоном pH от 2 до 11 и с этим расчетом подбирать электроды. Указанному диапазону pH удовлетворяют почти все типы стеклянных электродов, причем в диапазоне от 2 и примерно до 7—8 pH их показания практически не зависят от присутствия металлических катионов. Хингидронный электрод для всего указанного диапазона не пригоден, им можно пользоваться лишь в нейтральных или очень слабощелочных средах. Поэтому анализ солонцов и содовых солончаков хингидронным электродом проводить нельзя.
Второе условие выбора электродов связано с составом анализируемой среды. Водные и солевые вытяжки и суспензии почв содержат разнообразные органические соединения, включая высокомолекулярные (белки и т. п.), затем неорганические ионы, включая NH4+, коллоидные частицы органического и минерального происхождения. Концентрация неорганических солей в случае засоленных почв может достигать 1 н. и выше. Естественно, что далеко не всякий метод и не всякий электрод пригоден для изучения подобных систем. Особенно многочисленны ошибки при определении pH колориметрическим методом и при использовании хингидронного электрода. На показания последнего влияют все окислители и восстановители, коллоидная фаза, избыток солей. Поэтому хингидронный электрод практически не пригоден, кроме уже перечисленных выше почв, также при анализе сильно-восстановленных почв (глеевых, оглеенных), почв и горизонтов, обогащенных как закисными, так и окисными соединениями железа. В наибольшей степени всем требованиям, предъявляемым при определении pH почв, отвечает стеклянный электрод.
Выбор потенциометра связан с особенностями используемых электродов. Для измерений с хингидронным электродом пригоден практически любой потенциометр, равно как и простая компенсационная схема Поггендорфа. В случае стеклянного электрода приходится прибегать к электронным потенциометрам (ЛПУ, рН-340 и т. п.). Конечно, потенциал стеклянного электрода можно измерить и на значительно более простых приборах, но практически это нецелесообразно.
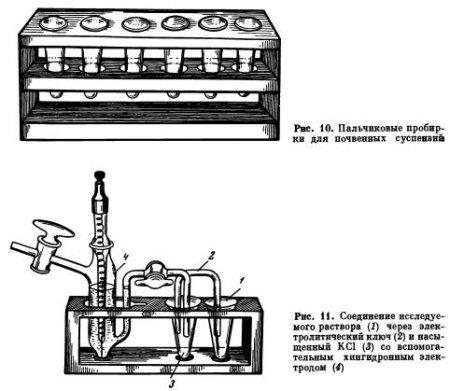
Определение pH с хингидронным электродом. Для определения pH почвы с хингидронным электродом готовят вытяжку или суспензию, как описано выше. Часть вытяжки отбирают в пальчикообразную пробирку (рис. 10). Пробирки должны быть чистыми и совершенно сухими, количество взятой вытяжки не имеет значения, поскольку описываемыми методами измеряется не общее содержание, а концентрация Н+-ионов; существенно только, чтобы взятый объем был достаточен для погружения в него платинового электрода и электролитического ключа. К раствору (вытяжке) добавляют немного (на кончике ножа) хингидрона, слегка встряхивают, чтобы хингидрон равномерно распределился по всему объему. Затем через электролитический ключ вытяжку соединяют с пробиркой, заполненной насыщенным раствором KCl, и далее со вспомогательным полуэлементом; обычно это тот же хингидронный электрод, приготовленный на буферном растворе с известным значением pH (рис. 11). В пробирку с вытяжкой опускают платиновый электрод; для этой цели пригодны игольчатый и копьевидный электроды, описанные в разделе об электродах для измерения ОВП. Поскольку во вспомогательном полуэлементе используется буферный раствор с pH около 2, то последний в собранной цепи имеет знак плюс, а индикаторный электрод знак минус; соответственно знакам полуэлементы подключают к потенциометру или схеме Поггендорфа и измеряют э.д.с., как описано выше.
Найденная э. д. с. равна разности потенциалов индикаторного и вспомогательного электродов:
э.д.с. = εвсп - εинд = ε0 - 0,0581 рНвсп - ε0 + 0,0581 pHх (при 20°С)
Отсюда:
рНх = э.д.с./0,0581 + рНвсп.
В случае, когда pH почвенной суспензии оказывается ниже, чем pH вспомогательного электрода, то меняют полюсность на приборе, а расчет ведут по формуле
рНх = рНвсп - э.д.с./0,0581.
Определение рН со стеклянным электродом. Цепь для измерения pH со стеклянным электродом может быть составлена по-разному в зависимости от вида применяемых электродов. В случае комбинированного электрода последний просто погружают в вытяжку или суспензию, а выходной штеккер подключают к потенциометру. Если используется внешний вспомогательный электрод, то в зависимости от типа последнего его или непосредственно погружают в испытуемый раствор вместе со стеклянным электродом, или соединяют, как описано выше, через электролитический ключ.
Непосредственное нахождение величины pH также возможно двумя способами. В первом из них прямо берут отсчет по предварительно отградуированной шкале pH на потенциометре. Во втором измеряют только э.д.с. в милливольтах; сначала проводят измерения для серии буферных растворов и строят график в координатах э.д.с. — pH, затем находят э.д.с. для цепи с испытуемым раствором и по графику находят величину pH.