Аминокислоты - производные аспарагиновой кислоты (часть 2)
Атом серы вводится в молекулу метионина из цистеина, который в тканях растений реагирует с О-фосфогомосерниом в присутствии фермента цистатионин-β-синтегазы с образованием тиоэфира цистатионнна, центрального интермедиата в переносе серы (см. рис. 2.6). Широко распространенный в растительных тканях фермент цистаттонин-β-лиаза катализирует затем реакцию β-элиминирования, в результате которой из цистатионина образуются гомоцистеин, пируват и аммоний. Конечный этап образования метионина — введение метальной группы, донором которой, скорее всего, служит одно из производных фолиевой кислоты, очень подвижных переносчиков активированных одноуглеродных фрагментов в реакциях биосинтеза. Аминокислота метионин играет важную роль в обмене веществ не только как составная часть белков, но и как донор метальной группы (в виде S-аденозилмешонина) в различных клеточных процессах, кроме того, она необходима для инициации синтеза белка.
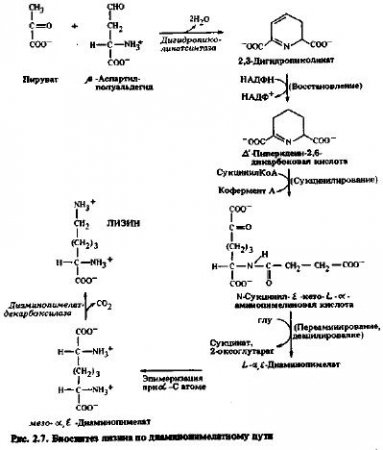
Образование лизина начинается от β-аспартилполуальдегида по диаминопимелатному пути биосинтеза (рис. 2.7). Эта последовательность реакций включает исходную конденсацию пирувата с полуальдегидом с образованием дигидропиколинатa, который затем восстанавливается и подвергается реакциям сукцинилирования, переаминирования и деацилирования с образованием диаминолимелата, конечное декарбоксилирование которого дает лизин. Второй атом азота вводится в лизин в реакции переаминирования. Было показано, что первый фермент, специфичный для синтеза лизина, дигидропиколинатсинтаза, а также завершающий фермент пути, диаминопимелатдекарбоксилаза, в зеленых листьях локализованы в хлоропластах, однако присутствие остальных ферментов этого биосинтетического пути в растительных тканях предстоит доказать. Вероятно, в зеленых листьях эти ферменты также локализованы в хлоропластах, однако это предположение нуждается в подтверждении.
В этом разветвленном пути биосинтеза есть несколько точек регуляции. Аспартаткиназа, первый фермент, общий для синтеза лизина, метионина, треонина и изолейцина, существует в изоформах, чувствительных к угнетению лизином или треонином, которые, таким образом, могут ингибировать собственный синтез, регулируя превращение аспартата через β-аспартилфосфат. В некоторых тканях растений присутствие метионина или S-аденозилметионина может усиливать угнетающее действие лизина на аспартаткиназу. Однако при сопоставлении данных, полученных при исследовании различных растительных тканей, мы не можем составить единой картины регуляции. Лизин может регулировать свой синтез и благодаря высокой чувствительности дигидропиколинатсинтазы, первого фермента на ответвлении биосинтетического пути к лизину, к угнетению этим конечным продуктом. Поэтому любое накопление лизина должно быстро привести к прекращению его биосинтеза. Гомосериндегидрогеназа, первый фермент на ответвлении метаболического пути, общего для образования метионина и треонина, существует в виде нескольких изоферментов, ряд из которых ингибируются треонином, так что регуляция активности этого фермента треонином контролирует поток β-аспартилполуальдегида по этому ответвлению биосинтетического пути. Активность треонинсинтазы, вероятно, регулируется содержанием цистеина и S-аденозилметионина в клетке. При высоком уровне цистеина (участвующего в биосинтезе метионина) треонинсинтаза угнетается, а присутствие S-аденозилметионина оказывает на фермент стимулирующее действие. Благодаря такой регуляции при высоком уровне цистеина и низком содержании S-аденозилметионина в клетке превращение О-фосфогомосерина в лизин происходит очень медленно. Такое угнетение треонинсинтазы позволяет направить О-фосфогомосернн на синтез метионина, а затем и S-аденозилметионина. В результате, когда достигается критическое содержание S-аденозилметионина, снимается угнетение треонинсинтазы и возобновляется синтез треонина.