Аминокислоты - производные аспарагиновой кислоты (часть 1)
Аспартат образуется в реакции переаминирования, в которой донором аминогруппы служит глутамат, а 2-оксокислотой - акцептором промежуточных продуктов цикла трикарбоновых кислот - оксалоацетат:
Биосинтез аспарагина. Второй атом азота в молекулу аспартата вводит фермент аспарагин-синтетаза. Фермент катализирует амидирование аспартата, используя в качестве донора аминогруппы глутамин и образуя аспарагин:
Аспарагинсинтетазы были выделены из нескольких растительных тканей, и было показано, что фермент характеризуется низкой величиной Км для глутамина при высокой Км для аммония. Во многих растительных клетках аспарагин накапливается в высоких концентрациях.
Второй путь образования аспарагина служит способом обезвреживания цианида. Для этого пути необходимы CN- и ферменты β-цианоаланин-синтетаза и β-цианоаланингидролаза, катализирующие реакции:
Цистеин + CN- → β-Цианоаланин + H2S
β-Цианоапаннн + H2O → Аспарагин
Растительные ткани, например проростки люпина, обладающие способностью обезвреживать цианид, образуют аспарагин также через аспартат и аспарагинсинтетазу.
Биосинтез лизина, треонина, изолейцина и лейцина. Будучи предшественником в биосинтезе пиримидинов, аспартат служит также исходным субстратом в синтезе аминокислот лизина, треонина, изолейцина и метионина. Вначале ферменты аспартаткиназа и аспартат-β-полуальдегиддегидрогеназа превращают аспартат в полуальдегид подобно тому, как глутамат превращается в глутаматполуальдегид. В этой точке разветвляется путь синтеза метионина и треонина и диаминопимелатный путь (названный так по одному из его ключевых интермедиатов), ведущий у высших растений к образованию лизина (рис. 2.6 и 2.7).
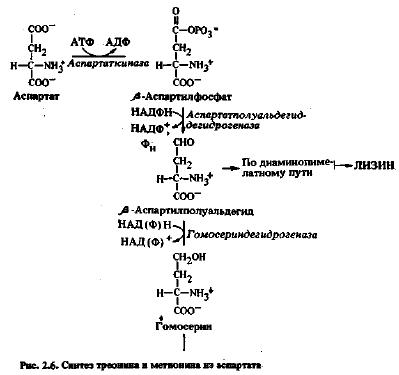
Общий для метионина и треонина путь через гомосерин к О-фосфогомосерину разветвляется здесь на два. Гомосерин — это аминокислота, которая редко встречается среди свободных аминокислот, но преобладает в фонде свободных аминокислот в проростках гороха. Треонин образуется из О-фосфогомосерина в реакции, включающей удаление неорганического фосфата и переход гидроксильной группы от γ- к β-углеродному атому в боковой цепи аминокислоты (см. рис. 2.6). В свою очередь, треонин служит предшественником для аминокислоты изолейцина, биосинтез которой обсуждается ниже.