Определение нуклеиновых кислот по методу Андерсона
Метод основан на декальцировании почв 0,1 н. HCl, экстракции органофосфатов 0,3 н. NaOH при 20° С 16 час., осаждении ДНК и части РНК с гуминовыми кислотами при pH 1, их гидролизе в 50% HClO4, реосаждении и рерастворении продуктов гидролиза ДНК и РНК в целях их очистки, идентификации и определения азотистых оснований (пуринов, пиримидинов) с помощью ионообменной и бумажной хроматографии, спектрофотометрии (при 250-290 нм) и др.
Ход анализа. 20 г воздушно-сухой почвы (сито d 1—2 мм) помещают в центрифужные пробирки емкостью 250 мл, приливают 100 мл 0,1 н. HCl. взбалтывают 1 час, центрифугируют и растворы выбрасывают. Остаток почвы в пробирке заливают 100 мл 0,3 н. NaOH и настаивают при 20° С 16 час. с периодическим перемешиванием суспензии. После этого суспензия центрифугируется, а к почве добавляют еще 50 мл 0,3 н. NaOH, взбалтывают несколько минут от руки и центрифугируют. Прозрачные щелочные экстракты объединяют и сливают в другие пробирки, затем их подкисляют концентрированной HCl до pH 1 и оставляют на 10 мин. для коагуляции осадка гуминовых кислот. Суспензию центрифугируют, промывают водой, вновь центрифугируют. Растворы выбрасывают, а отмытые осадки гуминовых и нуклеиновых кислот подвергают промораживанию при -5, -15° С в течение ночи, затем их оттаивают и высушивают в вакууме при 50° С. Сухой осадок обрабатывают 2 мл 50% HClO4 (или несколько больше кислоты, если больший размер осадка) и нагревают на кипящей водяной бане в течение 1 часа. Образующийся при этом осадок разбивают время от времени стеклянной палочкой. Суспензия разбавляется затем водой до 15 мл, настаивается 10 мин., центрифугируется. Осадок промывают один раз водой (5—10 мл), центрифугируют. Центрифугат и промывная жидкость объединяются и сливаются в другие пробирки, к ним осторожно, по каплям приливают 2 н. KOH до pH 4,0, при этом осаждается перхлорат калия, полуторные окислы, органические вещества.
Суспензию далее нагревают на водяной бане в течение 5 мин., охлаждают, центрифугируют и промывают водой (5—10 мл). Прозрачный центрифугат и промывную жидкость объединяют и сливают в пробирки, упаривают на слабокипящей водяной бане примерно до 10 мл, добавляют 1 каплю NH4OH до pH 10. Если при этом выпадает осадок, то его удаляют центрифугированием, промыванием, и объем исследуемого раствора вновь упаривают до — 10 мл. После этого раствор, содержащий пуриновые и пиримидиновые основания, пропускают со скоростью 0,5 мл/мин через колонку (13х1 см), заполненную анионитом ДАУЭКС-1 (100—200 меш.) в формиатной форме (СООН-форма). Элюцию проводят со скоростью также 0,5 мл/мин сначала с 20 мл буферного раствора HCOONH4 с pH 9,4, а затем 400 мл того же раствора, но с pH 6,2.
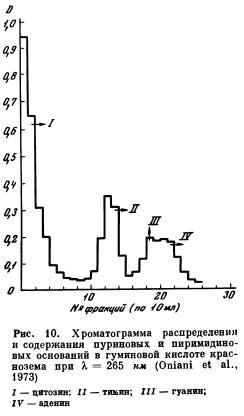
С помощью автоматического устройства в кюветах собирают фракции по 10 мл элюата. Все собранные фракции пропускают затем через спектрофотометр, сначала при длине волны 265 нм, а затем при 250, 260, 270, 280, 290 нм на фоне буферного раствора HCOONH4. С помощью известных кривых идентифицируют выделенные соединения азотистых оснований. На рис. 10 представлены результаты ионообменной хроматографии азотистых оснований, выделенных из гидролизатов нуклеиновых кислот.
Из полученных на хроматограммах пиков, соответствующих определенному номеру выделенной фракции, отбирается аликвотная часть элюата и либо с дополнительной очисткой, либо без нее переносится на хроматографическую бумагу для установления присутствия отдельных форм НК. Цитозин элюировали буфером при pH 9,4; тимин, аденин, гуанин — буфером при pH 6,2. Перед хроматографированием на бумаге фракции цитозина очищали на катионите. Растворы, содержащие аденин, гуанин, тимин, выпаривали, сухие остатки растворяли в 0,1 н. HCl и наносили на бумагу. Цитозин и тимин разгоняли нисходящим способом в течение 16 час. в растворителе н-бутанол — NH4OH. Гуанин и аденин разгоняли на восходящей хроматограмме 16 час. в растворителе пропанол : HCl.
Реактивы. 1. 0,1 н. HCl и HCl (уд. вес 1,19).
2. 0,3 н. NaOH.
3. 50%-ная HClO4 (или 30-72%-ная HClO4).
4. 2 н. КОН.
5. 25%-ный NH4OH.
6. 1 M раствор HCOOH (муравьиной кислоты).
7. Буферный раствор HCOONH4 с pH 9,4. 10 мл 1 M раствора HCOOH разбавляют водой до 950 мл и добавляют по каплям крепкий NH4OH до pH 9,4.
8. Буферный раствор HCOONH4 с pH 6,2. 5 мл 1 M раствора HCOOH доводят водой до 1 л, перемешивают. Смешивают растворы 7 и 8 в таких соотношениях, чтобы получить раствор HCOONH4 с pH 6,2.