Аминокислоты и их производные в механизме иммобилизации
Азотный метаболизм играет центральную роль в адаптации растений к избытку тяжелых металлов. В ответ на их воздействие в растениях накапливаются специфические аминокислоты, пептиды, амины, металлотионеины, фитохелатины и др., участвующие в детоксикации тяжелых металлов.
Пролин. Накопление этого соединения — характерная реакция растений на воздействие различных разновидностей абиотического стресса: избытка тяжелых металлов засоления, водного дефицита, экстремальных температур. Индуцированная металлами аккумуляция пролина сопоставима по своей амплитуде и другим характеристикам с действием иных стрессовых факторов абиотической природы. В листьях неустойчивого вида Silene vulgaris концентрация пролина под воздействием тяжелых металлов (Cd>Zn>Cu) возрастала более чем в 20 раз. В корнях эта ответная реакция проявлялась в меньшей степени.
Уровень пролина в корнях устойчивых к избытку металлов растений
(Armeria maritime, Deschampsia cespitosa, Silene vulgaris) выше по сравнению с неустойчивыми даже в отсутствие избытка металлов. Экотипы Cu-толерантного вида
Armeria maritime, выращенные в почве с высоким содержанием меди, характеризовались более высоким содержанием пролина в корнях, чем выращенные в почве с низким содержанием этого металла. Аналогичная зависимость — у Zn-толерантных и Zn-нетолерантных клонов
Desehampsia cespitosa. По сравнению с диким видом трансгенные водоросли
Chlamydomonas reinhardtii продуцировали на 80% больше пролина и лучше росли при более высокой концентрации кадмия в среде.
Детоксикация с участием пролина тяжелых металлов возможна в результате их связывания в комплексы (иммобилизации), а также проявления пролином свойств антиоксиданта и регулятора. В корнях толерантного вида
A. maritima (опыты in vivo) медь находилась в форме комплексов с пролином. В отличие от меди кадмий не входил в состав пролиновых комплексов, его избыток индуцировал синтез других хелатирующих соединений — фитохелатинов.
Окислительный стресс вызывает у растений повреждения в условиях избытки химических элементов. Описаны реакции взаимодействии пролина с активными формами кислорода, в частности с ОН-, но не с супероксидными радикалами. Обработка
Chlorella vulgaris экзогенными формами пролина предотвращала пероксидное окисление липидов в мембранах, вызываемое тяжелыми металлами: медью, хромом, никелем, цинком. Концентрация в водорослях эндогенных форм пролина также возрастала. В клетках трансгенных штаммов
С. reinhardtii, продуцировавших много пролина, концентрация окисленных форм глутатиона (важнейшего антиоксиданта) была а четыре раза меньше, чем в клетках дикого вида.
Гистидин. Играет важную роль в транспорте никеля из корней в побег и адаптации растений к избытку этого металла. У гипераккумулятора никеля
Alyssum lesbiacum концентрация гистидина (Гис) в ксилемном соке с увеличением концентрации никеля в среде возрастала. У представителей
A. montanum, не накапливающих в своей биомассе в обычных условиях Гис и никеля, после обработки экзогенным Гис обнаружено усиление транспорта этого металла в побег и увеличение Ni-толерантности растений. Комплексы Гис с цинком обнаружены в корнях гипераккумулятора цинка
Thlaspi caerulesсens. Трансгенные растения
Arabidopsis thaliana, характеризовавшиеся вдвое большим уровнем Гис, формировали при токсичных концентрациях никеля, биомассу в 10 раз более высокую, чем представители дикого вида. Связь между уровнем содержания Гис в клетках и толерантностью к никелю и другим металлам выявлена у дрожжей
Satcharvmyces cerevisiae.Другие аминокислоты. В детоксикации тяжелых металлов в тканях растений могут участвовать кроме Гис другие аминокислоты, в частности аспарагин. Егo количество в корнях и соответственно устойчивость нетолерантных клонов
Desehampsia cespitosa к избытку цинка были выше на фоне аммонийного в отличие от нитратного питания растений.
В соке ксилемы катионы меди, никеля к цинка связываются не только цитратом, но и аминокислотами (Гис). В ксилемном соке растений
Alyssum обнаружены следующие комплексы никеля (процент от общего содержания никеля): гистидиновые 19, глутаминовые 15, цитраткые 9, малатные 3. В комплексах с Гис никель координирован аминокислотным азотом. В целых листьях и корнях растений этого рода зарегистрированы идентичные спектры. В ксилемном соке сои и томатов количество свободных катионов меди не превышает 1%. Преимущественное связывание цинка аминокислотами отмечено при более высоких значениях pH ксилемного сока. В клетках мезофилла (ячменя) общая концентрация аминокислот в компартментах, окружающих вакуоль, была вдвое выше, чем в вакуолях, и составляла около 100 ммоль/л. Повышенный уровень аминокислот в компартментах с активным метаболизмом, возможно, необходим для связывания металлов.
В соке флоэмы
(Yuссa) катионы меди и цинка связаны следующими аминокислотами: аспартатом (Асп), глутамином (Глу) и тирозином (Тир). В форме оксалатов отмечены железо, кальций и магний. Примерно половина щавелевой кислоты содержалась в свободном виде.
Относительно высокая устойчивость растений-аккумуляторов селена к ею избытку обусловлена их способностью предотвращения появления селеноцистеина и селенометионина в клетках и включения этих соединений в состав белков. Селенометионин не синтезируется вследствие трансформации его предшественника селеноцистеина в небелковые аминокислоты: селенометилцистеин. у-глутамил-Se-метилселеноцистеин, селеноцистатионин.
Полиамины. Полимеры, содержащие в повторяющемся звене макромолекулы первичные, вторичные, третичные или четвертичные аминогруппы. Термин «полиамины» используют также для обозначения низкомолекулярных и олигомерных аминов, содержащих в молекуле две или более аминогруппы.
Играют важную роль в регуляции роста и развития растений. Полиамины, содержащие первичные и вторичные аминогруппы, образуют комплексы с ионами металлов: Cu2+, Co2+, Ni2+, Fe2+, Fe3+. Связываясь с отрицательными зарядами мембран, полиамины способны предотвращать вызываемое кадмием и медью пероксидное окисление мембранных липидов. Полиамины спермин, спермидин, путресцин и кадаверин нейтрализовали отрицательное действие свободных радикалов. Избыток тяжелых металлов в среде индуцирует неоднозначные изменения в концентрации полианинов в растениях. У фасоли в ответ на Cd-стресс концентрация путресцина увеличивалась в корнях, гипокотиле и эпикотиле. Концентрация спермидина увеличивалась а гипокотиле, уменьшалась — в листьях. Концентрация спермина уменьшалась во всех органах. Под влиянием кадмия концентрация полиаминов (путресцина, спермидина и спермина) увеличивалась в клубеньках и уменьшалась в корнях сои. Очевидно, в корнях синтез этих азотсодержащих дериватов подавлялся больше, чем в клубеньках.
Глутатион. Трипептид (2-амино-5-[[2-[(карбоксиметил)амино]-1-(меркаптометил)-2-оксоэтил]амино]-5-оксопентаноевая кислота, содержащий необычную пептидную связь между аминогруппой цистеина и карбоксигруппой боковой цепи глутамата. Роль глутатиона в клетке определяется его участием в связывании тяжелых металлов и переносе их на металлотионеины и фитохелатины, а также антиоксидантными свойствами. Глутатион защищает клетку от токсического действия радикалов и в целом определяет величину окислительно-восстановительного потенциала внутриклеточной среды. Уменьшение уровня глутатиона в растениях — один из главных признаков раннего проявления токсического действия тяжелых металлов, свидетельствующий об опасности нарушения клеточного гомеостаза. Выявлена тесная связь между концентрацией глутатиона в растениях гороха десяти сортов и их толерантностью к избытку кадмия. Склонность растений
Thlaspi к сверхнакоплению никеля также зависела от концентрации в растениях глутатиона.
Металлотионеины. Группа богатых цистеином (Цис) молекул, связывающих тяжелые металлы в комплекс с помощью восстановленных тиоловых групп. Металлотионенины (MT) встречаются у организмов разных групп. Металлотионеины млекопитающих состоят из 61 молекулы аминокислот, 20 из них — молекулы цистеина. Последние потенциально связывают семь эквивалентов катионов двухвалентных металлов. Типичный МТ-комплекс состоит из двух доменов: металл4Цкс9 и металл4Цис11 (рис. 7.2). Оба домена сопряжены двумя-четырьмя молекулами аминокислот.
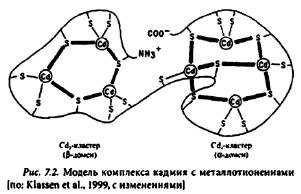
Выделены три класса металлотионеинов. Первый класс (MT-I) включает молекулы MT, в которых цистеин представлен следующими сочетаниями: Цис-Цис, Цис-Х-Цис, и Цис-ХХ-Цис, где X — другие аминокислоты. Металлотионеины этого класса обычны для млекопитающих, некоторых рыб. крабов, устриц и мидий. Пептиды второго класса (MT-Il) отличаются от пептидов первого лишь спецификой позиций цистеина. Этот класс обнаружен у дрозофил, нематод, грибов, цианобактерий и растений (зародыши пшеницы). Пока лучше всего изучен механизм связывания молекулами MT-II кадмия и цинка. У растений некоторых экотипов транскрипция MT-II индуцируется кадмием, цинком и медью.
Металлотионеины третьего класса (MT-III) устроены нетипично: цистеин сочетается с γ-глутаминовой кислотой (Глу) и образует последовательности (γ-Глу-Цис)n*Глу, где n варирует от 2 до II; MT-III характерны для цветковых и голосеменных растений, грибов, водорослей, мхов, папоротников. Впервые выявлены в делящихся клетках дрожжей
Schizosaccharomyces pombe. Относительно недавно металлотионеины класса MT-IH стали называть фитохелатинами.
Фитохелатины. По структуре фитохелатины сходы с глутатионом и классифицируются по виду терминальной аминокислоты пептида. Всего выделено пять семейств фитохелатинов: семейство глицина, β-аланина (Ала), цистеина, серина (Сер) и глутаминовой кислоты. В каждом семействе пара γ-Глу-Цис повторяется от двух до семи раз в зависимости от вида организма и условий среды, Фитохелатины семейства глицина (Гли) характеризуются следующим составом: (γ-Глу-Цис)n*Гли. Представители этого семейства появляются у растений различных видов (от мхов и лишайников до высших растений) в ответ на добавление кадмия в среду. Структура пептидов семейства β-аланина (γ-Глу-Цис)n-β-Ала. Они обнаружены в растениях семейства бобовых (Fabacea). Бобовые тринадцати видов продуцируют в ответ на загрязнение кадмием только пептиды семейства β-аланина, тогда как двадцати двух видов — пептиды не только семейства β-аланина, но и семейства глицина. Третье семейство фитохелатинов, типичное для злаков (Роасеае), включает пептиды (γ-Глу-Цис)n. Они служат субстратом для биосинтеза глутатиона. Четвертое семейство (γ-Глу-Цис)n-Cep также характерно для злаков: риса, пшеницы, ржи и овса, за исключением кукурузы. Наконец, представители пятого семейства — (γ-Глу-Цис)n-Глу — изолированы из корней кукурузы после выращивания растений в обогащенной кадмием среде.
Глутатион — субстрат для синтеза фитохелатинов, катализируемого γ-глутамияцистеиндипептидилтранспептидазой или фитохелатинсинтазой. Фитохелатинсинтаза Arabidopsis thaliana молекулярной массой 55 кД состоит из 485 аминокислот. Биосинтез глутатиона происходит в вакуолях. Поэтому в растениях фермент локализован в тканях с высокой вакуолизацией: листьях (главным образом, в трихомах), корнях, семядолях, стеблях, его нет в кончиках корней или корневых волосках.
Биосинтез фитохелатинов индуцируют следующие имеющие сродство к SH-гpyппам ионы химических элементов: Ag+, As+, Au+, Bi3+, Cd2+, Cu2+, Hg2+, Ni2+, Pb2+, Sb3+, Se3+, Sn2+, Te4+, W6+, Zn2+, Fe2+, Сa2+, In2+, Pb2+, La2+. Эффективнее всего действует кадмий, а также серебро, висмут, свинец, цинк, медь, ртуть к золото. В растениях кукурузы аккумуляцию фитохелатинов вызывал кадмий, но не ртуть. Синтез фитохелатинов могут также индуцировать и необходимые для растений микроэлементы: цинк, никель, железо, молибден, марганец, однако участия фитохелатинов в детоксикации таких микроэлементов не выявлено. Защитная роль фитохелатинов обнаружена главным образом в отношении элементов, не относящихся к группе необходимых для растений: кадмия, ртути, мышьяка, за исключением цинка.
Детоксикация тяжелых металлов осуществляется благодаря связыванию их катионов SH-группами фитохелатинов. Эти соединения защищают от пагубного действия тяжелых металлов (Cd, Zn) многие растительные ферменты: РБФ-карбоксилазу, оксигеназу, нитратредуктазу, глицеральдегид-3-фосфатдегидрогеназу, алкогольдегидрогеназу, уреазу. После связывания фитохелатинами цинка и кадмия пороговые концентрации этих металлов, вызывающих падение активности ферментов на 50%, возрастали в 10-150 раз. Фитохелатины эффективнее, чем глутатион или цитрат, восстанавливали активность поврежденной кадмием нитратредуктазы.
Наиболее детально изучен механизм связывания фитохелатинами кадмия. Этот процесс осуществляется в два этапа:
1) образование низкомолекулярных комплексов;
2) образование высокомолекулярных комплексов.
Низкомолекулярные комплексы кадмия формируются в цитоплазме, а затем транспортируются в вакуоль с помощью АТФ-зависимых белков семейства ABC. Синтез высокомолекулярных фитохелатиновых комплексов локализован в вакуолях, т. е. в компартментах клетки с высоким содержанием катионов кадмия и сульфидов. В высокомолекулярных комплексах кадмия больше, чем в низкомолекулярных. В целом прямое определение концентрации комплексов фитохелатинов с металлами или металлоидами затруднено, что ограничивает наши представления о стехиометрии образования таких комплексов.
Растения многих видов реагируют на уменьшение в среде концентрации тяжелых металлов снижением содержания фитохелатинов (период полураспада около трех дней). Обратная зависимость — увеличение концентрации фитохелатинов в тканях в ответ на увеличение концентрации тяжелых металлов в среде — обнаруживается не всегда, так как у толерантных растений в детоксикации металлов могут быть задействованы другие органические лиганды или механизмы, не связанные с синтезом фитохелатинов. Например, растения-гипераккумуляторы меди, кадмия, мышьяка и цинка характеризовались низким уровнем продуцирования фитохелатинов, не коррелированным с концентрацией этих элементов в среде.
Энергетические затраты, связанные с восстановлением серы и синтезом фитохелатинов, трудно признать целесообразными в эволюционном плане, если предположить. что фитохелатины задействованы только в механизме устойчивости растений к избытку кадмия. Возможно, эволюция биосинтеза фитохелатинов связана с их ролью переносчиков серы в восстановлении сульфатов, веществ, защищающих растительный организм от окислительного стресса или лигандов, транспортирующих металлы из корней в побег.
Фитин. Встречается главным образом в виде глобоидных включений внутри белковых тел. Основные запасы фитина сосредоточены в зрелых семенах, но и он встречается в вегетативных органах растений. В молодых корнях
Deschampsia caespitosa фитин приурочен к кортикальным клеткам зон растяжения. Толерантные растения
D. caespitosa формировали фитаты цинка интенсивнее, чем чувствительные. Образование таких отложений в клетках эндодермы и перицикла кончиков корней — специфическая реакция на избыток цинка многих культурных растений. В присутствии кадмия подобный ответ не зафиксирован.
Ферритин. Встречается главным образом в строме пластид хлоропластов. Способен связывать железо, предотвращая отложение этого металла в хлоропластах в случае его избытка. В пластидах хрустальной травки
(Mesembryanihemum crystallinum L.) отложения ферритина обнаружены в условиях избытка, а не дефицита железа. Ферритин в цитоплазме и в пространстве между плазмалеммой и клеточными стенками рассматривают как результат утечки ферритина из поврежденных избытком железа хлоропластов. В мутантах dgl и brz гороха, способных накапливать железо и другие двухвалентные катионы в различных органах, в форме ферритина аккумулировалась только часть поступающего в избытке железа.